
| n |
| v |
| 4.6g |
| 23g/mol |
| n |
| v |
| 0.2mol |
| 0.2L |


科目:高中化学 来源: 题型:
| A、1L溶液中含有K+数目是0.1NA |
| B、1L溶液中含有K+、SO42-总数为0.1NA |
| C、1 L溶液中K+的浓度是0.05 mol?L-1 |
| D、2 L溶液中含有SO42-的浓度是0.1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等 |
| B、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| C、对于△H<0,△S>0的反应,不仅能自发进行,反应速率也很快 |
| D、S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2;则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

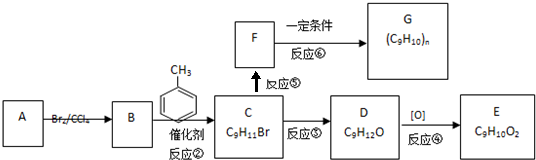
查看答案和解析>>
科目:高中化学 来源: 题型:
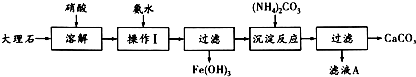
查看答案和解析>>
科目:高中化学 来源: 题型:
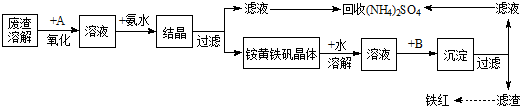
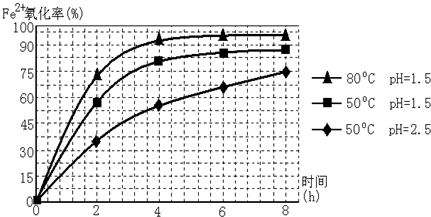
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
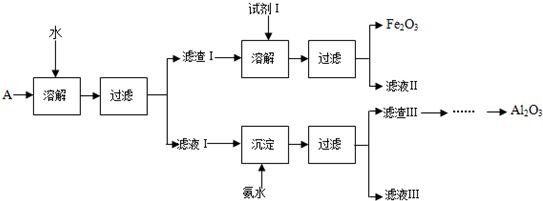
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、过程①加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→加盐酸后过滤 |
| B、在过程③中将MgCl2?6H2O灼烧即可制得无水MgCl2 |
| C、工业上通过电解饱和MgCl2溶液制取金属镁 |
| D、过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com