
| 试 管 | 未加MnSO4的试管 | 加有MnSO4的试管 |
| 褪色时间 | 30 s | 2 s |
| 试 管 | 未滴加稀硫酸的试管 | 滴加了稀硫酸的试管 |
| 褪色时间 | 100 s | 90 s |
| 试 管 | 滴入10滴稀硫酸的试管 | 加入1 mL稀硫酸的试管 | 加入2 mL稀硫酸的试管 |
| 褪色时间 | 70 s | 100 s | 120 s |


科目:高中化学 来源:不详 题型:单选题
 2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置
2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置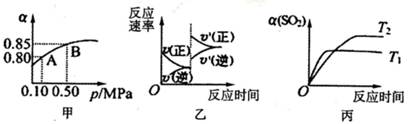
| A.由图甲推断,B点SO2的平衡浓度为0.3mol·L-1 |
| B.由图甲推断,A点对应温度下的平衡常数为80 |
| C.达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示 |
| D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>Tl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入适量的6mol/L的盐酸 | B.用酒精灯适当加热 |
| C.加入适量蒸馏水 | D.加入适量的氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.增大CO的浓度能减小反应速率 |
| B.升高体系温度能增大反应速率 |
| C.使用合适的催化剂可增大反应速率 |
| D.若反应在密闭容器中进行,H2和C0不能全部转化为产物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是| A.缩小体积 | B.恒容,充入He | C.恒容,充入O2 | D.恒压,充入N2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.③④ | C.②③ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3 ,改变下列条件,可以提高反应物中的活化分子百分数的是
2SO3 ,改变下列条件,可以提高反应物中的活化分子百分数的是| A.降低温度 | B.增大压强 | C.使用催化剂 | D.增大反应物浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加压有利于SO2与O2反应生成SO3 |
| B.温度过高对合成氨反应不利 |
| C.高温及加入催化剂都能使合成氨的反应速率加快 |
| D.用过量空气煅烧硫铁矿可以提高原料的利用率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO(g)+H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是| A.在密闭容器中通入水蒸气 |
| B.升温 |
| C.保持体积不变,充入氦气使体系压强增大 |
| D.保持压强不变,充入氦气使容器体积增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com