
下列表示对应化学反应的离子方程式错误的是
| A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+6H+=3I2+3H2O |
| B.向甲酸溶液中加入KOH溶液:HCOOH+OH-=HCOO-+H2O |
| C.将过量CO2通入冷氨水中:CO2+NH3?H2O=HCO3-+NH4+ |
| D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
D
解析试题分析:5I-+IO3-+6H+=3I2+3H2O中碘元素的化合价升降总数都是5,等号左右电荷总数都是0,各原子个数都相等,故A正确;甲酸是弱电解质或弱酸,甲酸钾是强电解质或可溶性盐,酸碱中和反应前后电荷守恒、原子守恒,故B正确;一水合氨是弱电解质或弱碱,二氧化碳是酸性氧化物或气体,因为二氧化碳过量,二者反应生成碳酸氢铵,碳酸氢铵是强电解质或可溶性盐,反应前后电荷守恒、原子守恒,故C正确;Ag+2H++NO3-=Ag++NO↑+H2O中氮元素化合价降低总数为3,银元素化合价升高总数为,得失电子数不相等,违反电子守恒原理,说明没有配平,正确的反应式为3Ag+4H++NO3-=3Ag++NO↑+2H2O,故D错误。
考点:考查离子方程式,涉及氧化还原反应、复分解反应、电子守恒、电荷守恒、原子守恒、弱电解质、强电解质、单质、气体等。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:单选题
下列离子方程式正确的是
| A.醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.碘水中通入足量的SO2:I2 +SO2+2H2O=2I-+SO42-+4H+ |
| C.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4: |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式表达正确的是( )
| A.向氯化铁溶液中滴加HI溶液:2Fe3++ 2HI = 2Fe2++2H++I2 |
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH—+Al3++2SO42-=2BaSO4↓+AlO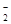 +2H2O +2H2O |
| C.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合:2AlO2-+5H+ = Al(OH)3↓+Al3++H2O |
| D.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式与所述事实相符且正确的是
| A.向稀氨水中逐滴加入稀硝酸银溶液配制银氨溶液:Ag++2NH3·H2O="[Ag" (NH3)2] ++2 H2O |
| B.用双氧水和稀硫酸可以蚀刻印刷电路板:Cu+H2O2+2H+=Cu2++2H2O |
C.硫化钾晶体溶于水:S2-+2H2 O 2OH-+H2S 2OH-+H2S |
| D.澄清石灰水与过量苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式正确的是
| A.氢氧化镁与稀盐酸反应:H+ + OH-=H2O |
| B.AlCl3溶液中加入少量氨水:Al3++3OH-=Al(OH)3↓ |
| C.铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
| D.次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在室温下,下列各组微粒在溶液中能大量共存的是
| A.Na+、Ba2+、OH-、Cl- | B.H+、Fe2+、ClO-、SO42- |
| C.K+、Fe3+、C6H5O-、SCN- | D.NH4+、Al3+、SiO32-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在溶液中能大量共存的一组离子或分子是
| A.K+ 、Al3+、SO42—、NH3·H2O | B.NH4+、H+、NO3—、HCO3— |
C.Na+ 、CH3COO—、CO32—、OH— | D.Na+、K+、SO32—、Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关说法正确的是( )
| A.一个SiO2分子中含有2个Si—O键,一个C2H4中含5对共用电子 |
| B.给铁皮镀锌可以有效的防止铁的电化学腐蚀 |
| C.金属氧化物和硝酸反应都只生成盐和水 |
| D.在强电解质水溶液中电解质全都以自由移动的离子形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)我国有广阔的海岸线,海水综合利用大有可为。海水中溴含量为65 mg·L-1,从海水中提取溴的工业流程如下: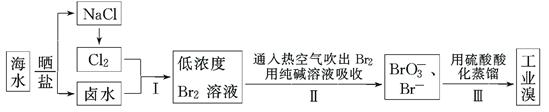
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是:
________________________________________________________________________。
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。
写出溴与二氧化硫水溶液反应的离子方程式:________________________________。
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是________。
A.乙醇 B.四氯化碳 C.裂化汽油 D.苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com