
【题目】某小组同学利用如图所示装置探究二氧化硫气体的性质.
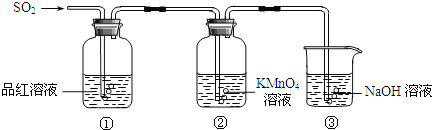
请回答:
(1)实验室用铜和浓硫酸共热制取二氧化硫,反应的化学方程式是 .
(2)当观察到②中溶液颜色变浅时,①中的现象是 .
(3)装置③的作用是 .
(4)①、②中的现象说明二氧化硫具有的性质是 .
【答案】(1)Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O(2)品红溶液褪色(或变浅)(3)吸收未反应的SO2,防止污染环境(4)漂白性、还原性
CuSO4+SO2↑+2H2O(2)品红溶液褪色(或变浅)(3)吸收未反应的SO2,防止污染环境(4)漂白性、还原性
【解析】解:(1)铜与浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)二氧化硫具有漂白性,将二氧化硫通入品红溶液后,会观察到①中品红溶液褪色(或变浅),
故答案为:品红溶液褪色(或变浅);
(3)二氧化硫为有毒气体,多余的二氧化硫不能直接排放,所以装置③中氢氧化钠溶液的作用是吸收未反应的SO2,防止污染环境,
故答案为:吸收未反应的SO2,防止污染环境;
(4)装置①中品红溶液褪色,证明二氧化硫具有漂白性;装置②中酸性高锰酸钾具有强氧化性,二氧化硫能够使酸性高锰酸钾溶液褪色,证明了二氧化硫具有还原性,
硅答案为:漂白性、还原性.


科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | Q | |
原子半径 | 0.186 | 0.074 | 0.099 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
其他 | 阳离子无核外电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)X和M的原子可构成 18 电子的分子,该分子的结构式为 。
(2)R元素的单质与水反应的离子方程式是 。
(3)Z与Q相比,金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 (填字母序号)。
a.Q的熔点比Z的熔点高,Q的硬度比Z的硬度大
b.Z与冷水反应迅速,而Q与冷水几乎不反应
c.Z的最高价氧化物对应水化物是强碱,而Q的最高价氧化物对应水化物具有两性
(4)与Y元素同主族的短周期元素E在自然界中存在多种核素,它们之间的关系互为 ,其中用于测定一些文物年代的核素的符号为 。
(5)写出Z2M2与X2M反应的化学方程式并标出电子转移关系。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,可以说明恒容密闭容器中的反应:P(g)+Q(g)![]() R(g)+S(g)在恒温下已达平衡状态的是
R(g)+S(g)在恒温下已达平衡状态的是
A.反应容器内压强不随时间变化
B. P和S的生成速率相等
C.反应容器内P、Q、R、S四者物质的量浓度为1:1:1:1
D.反应容器内总物质的量不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
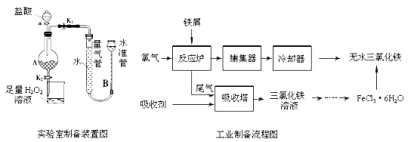
已知:(1)无水FeCl3的熔点为555K、沸点为588K。
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(1)烧杯中足量的H2O2溶液的作用是。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“……”的内容是__________。
(3)从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入后、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式:。
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为。
(6)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用cmolL-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-)。
①滴定过程中可能造成实验结果偏低的是
A.锥形瓶未润洗
B.锥形瓶中溶液变色后立刻停止滴定,进行读数
C.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡
D.滴定终点时仰视读数
②样品中氯化铁的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把等物质的量的Na2SO4、NaCl、AgNO3混合物放入足量水中,经充分搅拌后,将所得溶液用石墨电极进行电解,阳极生成的物质是( )
A.H2 B.Ag C.Cl2 D.O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测得某溶液中仅含有K+、Cu2+、SO42-、Cl-四种离子,其中K+、Cu2+、Cl-三种离子的个数比为4∶5∶8,则K+与SO42-的物质的量浓度之比为( )
A.2∶3 B.4∶1 C.4∶3 D.2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾可用作除草剂、净水剂或抗贫血药等.某研究小组同学采用硫铁矿焙烧后的烧渣(主要成份为Fe2O3、Al2O3和SiO2,不考虑其他杂质)制备绿矾,设计了如下流程.

请回答:
(1)①~③所涉及的实验操作方法中,用到过滤的是 (填序号).
(2)③中发生反应的离子方程式是 .
(3)下列说法正确的是(填字母) .
a.①中可选用盐酸,③中只能用硫酸
b.溶液B中含有OH﹣、SiO32﹣、AlO2﹣等阴离子
c.④中发生了氧化还原反应,固体C做还原剂
(4)原烧渣中Fe2O3的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196 kJ/mol。某温度下,向一体积为2L的密闭容器中充入0.2molSO2和0.1molO2,5min后达到平衡,共放出热量11.76kJ,下列说法正确的是
2SO3(g) △H=-196 kJ/mol。某温度下,向一体积为2L的密闭容器中充入0.2molSO2和0.1molO2,5min后达到平衡,共放出热量11.76kJ,下列说法正确的是
A.5min内用O2表示的反应速率为0.12mol/(L·min)
B.加入催化剂,可使该反应的化学反应速率加快,△H变小
C.SO2的平衡浓度为0.12mol/L
D.达到平衡时,若增大容器的体积,则该反应的化学反应速率减慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com