
【题目】绿矾可用作除草剂、净水剂或抗贫血药等.某研究小组同学采用硫铁矿焙烧后的烧渣(主要成份为Fe2O3、Al2O3和SiO2,不考虑其他杂质)制备绿矾,设计了如下流程.

请回答:
(1)①~③所涉及的实验操作方法中,用到过滤的是 (填序号).
(2)③中发生反应的离子方程式是 .
(3)下列说法正确的是(填字母) .
a.①中可选用盐酸,③中只能用硫酸
b.溶液B中含有OH﹣、SiO32﹣、AlO2﹣等阴离子
c.④中发生了氧化还原反应,固体C做还原剂
(4)原烧渣中Fe2O3的质量分数为 .
【答案】(1)①②(2)Fe(OH)3+3H+=Fe3++3H2O(3)ac(4)48.00%(或0.48)
【解析】解:烧渣主要成份为Fe2O3、Al2O3和SiO2,不考虑其他杂质,与足量酸混合,离子反应方程式为Fe2O3+6H+=2Fe3++3H2O、Al2O3+6H+=2Al3++3H2O,;
SiO2和酸不反应,然后过滤得到的固体A为SiO2,溶液A中含有H+、Al3+、Fe3+,加入足量碱,发生的反应为Fe3++3OH﹣=Fe(OH)3↓、Al3++4OH﹣=AlO2﹣+2H2O,然后过滤得到的滤液B中含有偏铝酸盐和碱,固体B为Fe(OH)3,为防止引进杂质,酸用稀硫酸,B和稀硫酸反应生成Fe2(SO4)3,C中含有硫酸和硫酸铁,加入固体C,为防止引入杂质,则固体C为Fe,发生氧化还原反应生成硫酸亚铁,然后蒸发浓缩、冷却结晶、过滤得到绿矾,
(1)通过以上分析知,采用过滤方法分离的是①②,故答案为:①②;
(2)氢氧化铁和酸反应生成铁盐和水,离子方程式为Fe(OH)3+3H+=Fe3++3H2O,故答案为:Fe(OH)3+3H+=Fe3++3H2O;
(3)a. ①的目的是溶解金属氧化物,③的目的是得到硫酸盐,所以①中可选用盐酸,③中只能用硫酸,,故正确;
b.通过以上分析知,溶液B中含有OH﹣、AlO2﹣,不含硅酸根离子,故错误;
c.④中发生了氧化还原反应,固体C做还原剂,失电子发生氧化反应,故正确;
故选ac;
(4)n[FeSO47H2O]=![]() =0.09mol,根据2Fe3++Fe=3Fe2+知,有
=0.09mol,根据2Fe3++Fe=3Fe2+知,有![]() 的亚铁离子来自于铁离子,所以根据Fe原子守恒得n(Fe2O3)=
的亚铁离子来自于铁离子,所以根据Fe原子守恒得n(Fe2O3)=![]() ×
×![]() ×n[FeSO47H2O]=
×n[FeSO47H2O]=![]() ×
×![]() ×0.09mol=0.03mol,m(Fe2O3)=0.03mol×160g/mol=4.8g,氧化铁质量分数=
×0.09mol=0.03mol,m(Fe2O3)=0.03mol×160g/mol=4.8g,氧化铁质量分数=![]() 100%=48.00%(或0.48),
100%=48.00%(或0.48),
故答案为:48.00%(或0.48).


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.同温同压下,相同体积的物质,它们的物质的量一定相等
B.任何条件下,等质量的一氧化二氮(N2O)和二氧化碳所含的分子数必相等
C.1 L一氧化碳的质量一定比1 L氧气质量小
D.等体积、等物质的量浓度的盐酸和硫酸中所含的H+数一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用如图所示装置探究二氧化硫气体的性质.
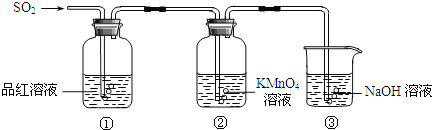
请回答:
(1)实验室用铜和浓硫酸共热制取二氧化硫,反应的化学方程式是 .
(2)当观察到②中溶液颜色变浅时,①中的现象是 .
(3)装置③的作用是 .
(4)①、②中的现象说明二氧化硫具有的性质是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A. 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-===Cl2↑
B. 氢氧燃料电池的负极反应式:O2+2H2O+4e-===4OH-
C. 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-===Cu2+
D. 钢铁发生电化学腐蚀的负极反应式:Fe-3e-===Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.100 mL 0.1 mol·L-1 Na2SO4溶液中,微粒总数是0.03 NA
B.标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定
C.常温常压下,32 g O2-中所含电子的数目为17 NA
D.标准状况下,11.2 L酒精含有的分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理、方法和结论都正确的是
A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚
D.已知I3-![]() I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素是构成细胞的最基本元素,对此最有说服力的解释是
A. 碳在细胞的各种化合物中含量最多
B. 碳在自然界中含量最为丰富
C. 在细胞的各种化合物中都含有碳
D. 碳链构成了有机物的基本骨架
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个烧杯中分别盛有海水,依次插入(1)铁片;(2)导线相连的铜、铁片;(3)导线相连的锌、铁片、铁在其中被腐蚀时由快到慢的顺序是
A. (1)(2)(3) B. (2)(3)(1)
C. (2)(1)(3) D. (3)(2)(1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3 溶液再生,其装置示意图如下:

①在阳极区发生的反应包括 和H++HCO3-![]() H2O+CO2↑。
H2O+CO2↑。
②简述CO32-在阴极区再生的原理 。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25 ℃,101 KPa下:
H2(g)+![]() O2(g)
O2(g)![]() H2O(g)ΔH1=-242kJ·mol-1
H2O(g)ΔH1=-242kJ·mol-1
CH3OH(g)+![]() O2(g)
O2(g)![]() CO2(g)+2H2O(g)ΔH2=-676kJ·mol-1
CO2(g)+2H2O(g)ΔH2=-676kJ·mol-1
①写出CO2和H2生成气态甲醇等产物的热化学方程式 。
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。

A B C D
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:
 、
、
①该电池外电路电子的流动方向为 (填写“从A到B”或“从B到A”)。
②A电极附近甲醇发生的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com