
向30mL 1mol/L的AlCl3溶液中逐渐加入浓度为4mol/L的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为
A.3mL B.7.5mL C.15mL D.17.5mL
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列物质间的转化在给定条件下能一步实现的是
①NH3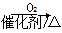 NO2
NO2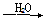 HNO3
HNO3
②SiO2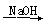 Na2SiO3
Na2SiO3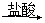 H2SiO3
H2SiO3
③Mg(OH)2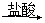 MgCl2(aq)
MgCl2(aq) Mg
Mg
④Na Na2O2
Na2O2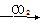 Na2CO3
Na2CO3
A.①②③ B.②④ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三上学期9月月考化学试卷(解析版) 题型:选择题
用右图表示的一些物质或概念间的从属关系中不正确的是
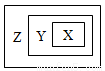
X | Y | Z | |
A | 苯的同系物 | 芳香烃 | 芳香族化合物 |
B | 胶体 | 分散系 | 混合物 |
C | 置换反应 | 氧化还原反应 | 离子反应 |
D | 碱性氧化物 | 金属氧化物 | 氧化物 |
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期9月学情调研化学试卷(解析版) 题型:填空题
磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图_____________________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500°C生成白磷,反应为:
2Ca3(PO4)2+6SiO2==6CaSiO3+P4O10 10C+P4O10==P4+10CO
每生成 1molP4 时,就有 mol电子发生转移。
(3)硫代硫酸钠(Na2S2O2)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素完全氧化,剩余的I2 用Na2S2O2溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定体积的某维生素C溶液中加入amolL-1I2溶液V1ml,充分反应后,用Na2S2O2溶液滴定剩余的I2,消耗bmolL-1 Na2S2O2溶液V2ml.该溶液中维生素C的物质量是 mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应,生成物之一可以用淀粉溶液检验。根据反应溶液出现蓝色所需的时间来衡量该反应的速率,写出该反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期9月学情调研化学试卷(解析版) 题型:选择题
下列叙述不正确的是
A.热的浓盐酸可以除去烧瓶内残留的MnO2
B.过量的铜与浓硝酸反应会有一氧化氮生成
C.稀硝酸可除去试管内壁的银镜
D.白磷在空气中加热到一定温度能转化成红磷
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二10月月考化学试卷(解析版) 题型:填空题
(13分)在固定容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g)随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g)随温度升高,混合气体的颜色变深。回答下列问题:
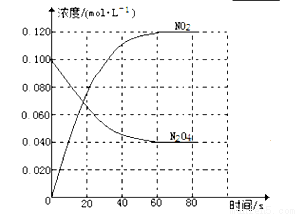
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 。 反应的平衡常数K1= 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②100℃时达到平衡后,向容器中再充入0.20mol NO2气体,新平衡建立后,NO2的体积分数
(填“增大”、“不变”或“减小”)
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二10月月考化学试卷(解析版) 题型:选择题
已知强酸与强碱在稀溶液里反应的中和热可表示为
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1 对下列反应:
CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-Q1 kJ·mol-1
H2SO4(浓)+NaOH(aq)===Na2SO4(aq)+H2O(l) ΔH=-Q2 kJ·mol-1
HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l) ΔH=-Q3 kJ·mol-1
上述反应均在溶液中进行,则下列Q1、Q2、Q3的关系正确的是( )
A.Q1=Q2=Q3 B.Q2>Q1>Q3 C.Q2>Q3>Q1 D.Q2=Q3>Q1
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三上学期第一次月考化学试卷(解析版) 题型:实验题
[化学](15分)三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设 l:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是__
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?_____________。筒述你的理由
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,则其质量比为__ _,写出其中发生的氧化还原反应的离子方程式 。探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg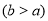 ,则混合物中Cu2O的质量分数为 。
,则混合物中Cu2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省无锡市高三上学期10月月考化学试卷(解析版) 题型:填空题
(12分)利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下:
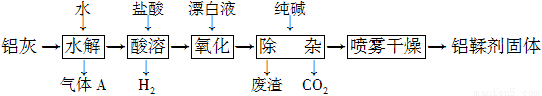
(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为____________。“水解”采用90 ℃而不在室温下进行的原因是________________。
(2)“酸溶”时,Al2O3发生反应的离子方程式为 。
(3)“氧化”时,发生反应的离子方程式为 。
(4)“废渣”成分为______________(填化学式)。
(5)采用喷雾干燥而不用蒸发的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com