
用右图表示的一些物质或概念间的从属关系中不正确的是
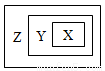
X | Y | Z | |
A | 苯的同系物 | 芳香烃 | 芳香族化合物 |
B | 胶体 | 分散系 | 混合物 |
C | 置换反应 | 氧化还原反应 | 离子反应 |
D | 碱性氧化物 | 金属氧化物 | 氧化物 |
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源:2015-2016学年江西省高一上第一次月考化学试卷(解析版) 题型:选择题
下列从混合物中分离出其中的某一成分,所采取的分离方法正确的是
A.利用氯化钾与碳酸钙的溶解性差异,可用溶解、过滤的方法除去碳酸钙
B.由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来
C.水的沸点是100 ℃,酒精的沸点是78.5 ℃,所以可用加热蒸馏法使含水酒精变为无水酒精
D.氯化钠的溶解度随温度的下降而减小,所以可用冷却法从热的含有少量氯化钾的氯化钠浓溶液中得到纯净的氯化钠晶体
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期期中测试化学试卷(解析版) 题型:填空题
(10分)Ⅰ.(1) P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________
a.NH3 b.HI c.SO2 d.CO2
(2)工业生产甲醇的常用方法是:CO(g)+2H2(g)  CH3OH(g) △H1 = —90.8kJ/mol。
CH3OH(g) △H1 = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H2 = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H3= -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H4 = 。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn == Fe2O3 +ZnO +2K2ZnO2该电池正极发生的反应的电极反应式为 。
II.用如图所示装置进行实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。
查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
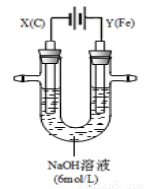
(4)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH- = FeO42-+4H2O和 。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江双鸭山第一中学高三上学期期中测试化学试卷(解析版) 题型:选择题
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液200 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
A.至少存在5种离子
B.Cl-一定存在,且c(Cl-) ≥0.2mol/L
C.SO42-、NH4+、Fe3+一定存在,Cl-可能不存在
D.CO32-、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三上学期第一次月考化学试卷(解析版) 题型:填空题
【化学—选修5:有机化学基础】(14分)
I、某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入适当过量稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入400 mL 0.5 mol/L的Na2SO3溶液,蓝色恰好完全退去。
(1)写出实验①中反应的离子方程式:_____________________。
(2)实验②的化学反应中转移的电子数为_______________。
(3)以上实验说明:在上述条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是___________________。
II、H2O2既有氧化性又有还原性,在+2价的锰盐或+3价的铬盐等催化下,会发生自身氧化还原反应,生成H2O和O2。完成并配平以下离子方程式:
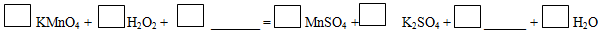
①反应中的氧化剂是______________;被氧化的元素是____________。
②若化学方程式中KMnO4、H2O2的系数分别是2和7,也能配平这个方程式,但此时H2O2除了跟KMnO4反应外,还发生的反应是(用化学方程式表示)___________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京大学附属中学分校高一上抽考化学试卷(解析版) 题型:选择题
下列反应中,氧化剂与还原剂的物质的量的关系为 1:2 的是
A.O3+2KI+H2O═2KOH+I2+O2
B.Ca(ClO)2+2CH3COOH═2HClO+Ca(CH3COO)2
C.I2+2NaClO3═2NaIO3+Cl2
D.4HCl(浓)+MnO2  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期期中测试化学试卷(解析版) 题型:选择题
科学家宣布发现了铝的“超级原子”结构——Al13和Al14。已知这类“超级原子”最外层电子数之和为40个时处于相对稳定状态.下列说法中,正确的是
A.Al13、Al14互为同位素
B.Al13超原子中Al原子间通过离子键结合
C.Al14最外层电子数之和为42,与第ⅡA族元素的性质相似
D.Al13和Al14都具有较强的还原性,容易失去电子生成阳离子
查看答案和解析>>
科目:高中化学 来源:2016届广东省高三上学期第二次教学质检化学试卷(解析版) 题型:选择题
向30mL 1mol/L的AlCl3溶液中逐渐加入浓度为4mol/L的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为
A.3mL B.7.5mL C.15mL D.17.5mL
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南华侨中学高二上会考模拟化学试卷(解析版) 题型:实验题
(10分)某化学研究性学习小组设计制取氯气及探究其性质的方案,并按下图所示装置完成实验。(A中发生反应的化学方程式为:MnO2 + 4HCl(浓) ====MnCl2 + Cl2↑ + 2H2O)
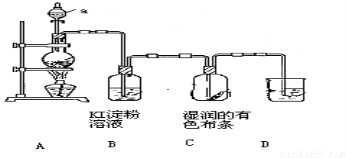
【实验探究】
(1)装置A中,仪器a的名称是 。
(2)装置B中无色溶液将变为 色,该反应的化学方程式是 。
(3)装置C中湿润的有色布条 (填“褪色”或“不褪色”),其原因是氯气与水反应生成了 (填化学式)
(4)为了吸收多余的氯气,防止造成空气污染,装置D中应盛放 溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com