
【题目】有机物A的键线式为: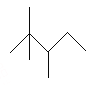 ,有机物B与等物质的量的H2发生加成反应可得到A。
,有机物B与等物质的量的H2发生加成反应可得到A。
下列有关说法错误的是
A. A的最简式为C4H9
B. A的一氯代物有5种
C. A有许多同分异构体,其中主链碳数为5有机物有5种(不包括A)
D. B的结构可能有3种,其中一种名称为:2,2,3—三甲基—3—戊烯
【答案】D
【解析】试题分析:A.根据键线式可写出A的结构简式为![]() ,分子中含8个,18个H,则A的最简式为C4H9,A项正确;B.由结构对称性可知,含5种H,A的一氯代物有5种,B项正确;C.主链含有5个C,侧链为3个甲基或1个甲基和一个乙基,若乙基在3号C上,甲基可分别在2、3号C上,有2种,若3个甲基,则2个甲基相邻、相间,另一个甲基各有2各位置,共4种,不含A有5种,C项正确;D.A中相邻碳原子上都含有H原子的可以含有碳碳双键,B的结构简式可能有如下三种:
,分子中含8个,18个H,则A的最简式为C4H9,A项正确;B.由结构对称性可知,含5种H,A的一氯代物有5种,B项正确;C.主链含有5个C,侧链为3个甲基或1个甲基和一个乙基,若乙基在3号C上,甲基可分别在2、3号C上,有2种,若3个甲基,则2个甲基相邻、相间,另一个甲基各有2各位置,共4种,不含A有5种,C项正确;D.A中相邻碳原子上都含有H原子的可以含有碳碳双键,B的结构简式可能有如下三种: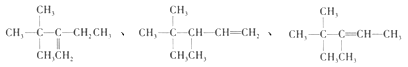 ,它们的名称依次为:3,3—二甲基-2-乙基-1-丁烯、3,4,4-三甲基-1-戊烯、3,4,4-三甲基-2-戊烯,D项错误;答案选D
,它们的名称依次为:3,3—二甲基-2-乙基-1-丁烯、3,4,4-三甲基-1-戊烯、3,4,4-三甲基-2-戊烯,D项错误;答案选D


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 含1molCl﹣的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA
C. 将CO2通过Na2O2使固体质量增加mg,反应中转移的电子数mNA/14
D. 17.6 g丙烷中所含的极性共价键为6.4 NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于丙烯分子(CH3﹣CH=CH2)的说法正确的是
A. 有 7 个 σ 键,1 个 π 键B. 分子式为 CH2
C. 最多有 7 个原子共平面D. 3 个碳原子在同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a升CO2气体通过足量Na2O2所得的气体与b升NO相混和时,可得到c升气体(相同状况),以下表达式中错误的是( )
A. 若a<b,则c>0.5(a+b) B. 若a>b,则c=0.5(a+b)
C. 若a=b,则c=0.5(a+b) D. 若a<b,则c<0.5(a+b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以绕键轴自由旋转,结构简式为如下图所示的烃,下列说法中正确的是( )

A. 分子中处于同一直线上的碳原子最多有6个
B. 分子中至少有12个碳原子处于同一平面上
C. 该烃苯环上的一氯代物共有 3种
D. 该烃苯环上一氯代物共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)具有较强的还原性,还能与中强酸反应,在精细化工领域应用广泛。将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3·5H2O(大苏打)。
(1)实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是________(填标号);检查该装置气密性的操作是:关闭止水夹,再_____________。
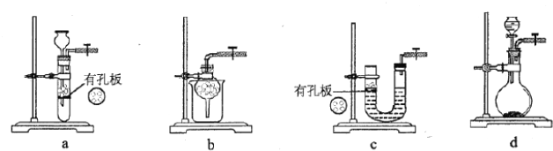
(2)向Na2S和Na2CO3的混合溶液中不断通入SO2气体的过程中,发现:
①浅黄色沉淀先逐渐增多,反应的化学方程式为_________________(生成的盐为正盐);
②浅黄色沉淀保持一段时间不变,有无色无味的气体产生,则反应的化学方程式为____________________(生成的盐为正盐);
③浅黄色沉淀逐渐减少(这时有Na2S2O3生成);
④继续通入SO2,浅黄色沉淀又会逐渐增多,反应的化学方程式为____(生成的盐为酸式盐)。
(3)制备Na2S2O3时,为了使反应物利用率最大化,Na2S和Na2CO3的物质的量之比应为____________;通过反应顺序,可比较出:温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液pH更大的是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“物质的量”是国际单位制中的一个基本物理量,下列有关说法正确的是( )
A.质量相等的CO和CO2,物质的量之比为2:3
B.2mol氧气的摩尔质量为62g/mol
C.1mol任何物质都含有6.02×1023个分子
D.2gH2含有1mol氢分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,足量的铝分别与下列酸反应时,放出H2最多的是 ( )
A. 600 mL 18.4mol·L-1的硫酸 B. 100 mL 1.0mol·L-1的盐酸
C. 200 mL 12 mol·L-1的浓硝酸 D. 600mL 0.1 mol·L-1的硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com