
【题目】下列元素原子半径最大的是
A. Li B. F C. Na D. Cl
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
B. 0.1mol ![]() 原子中含中子数为3.8NA
原子中含中子数为3.8NA
C. 足量的O2与1molNa充分反应,转移的电子数为NA
D. 50mL12mol·L-1的盐酸与足量MnO2共热,转移电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品。下列有关说法不正确的是( )
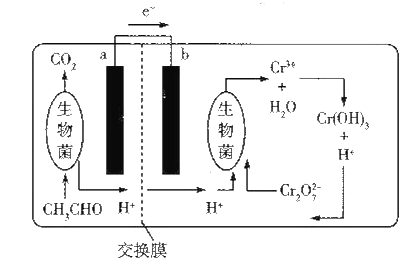
A. b极为正极,发生还原反应
B. 负极的电极反应式为CH3CHO-10e-+3H2O=2CO2↑+10H+
C. 理论上处理l mol Cr2O72-时有l4mol H+从交换膜左侧向右侧迁移
D. 放电时,交换膜右侧生物菌周围溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。其制取原理为: Al2O3+3C+N2![]() 2 AlN+3CO
2 AlN+3CO
为了分析某AlN样品中 AlN的含量,某化学研究性学习小组成员设计了如下两种实验方案。
【方案1——量气法】用图中的一些装置来进行相关实验,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)。

(1)图中仪器A的名称是 _______;写出AlN和NaOH溶液反应的化学方程式________。
(2)广口瓶中的试剂X最好选用下列试剂中的_______(填选项的标号),广口瓶的液体没有装满(上方留有少量空间),实验测得NH3的体积将________(填“偏大”、 “偏小”或“不变”)。
A.苯 B.酒精 C.植物油 D.CCl4
(3)若实验中测得样品的质量为2.56g,氨气的体积为1.12L(标况下),则样品中AlN的质量分数为______。
【方案2——测重量】按以下步骤测定样品中A1N的纯度:

(4)步骤②生成沉淀的离子方程式为_______________。
(5)步骤③的操作是_____________。
(6)A1N的纯度是______________(用m1、m2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧和钠能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_______;晶胞中氧原子的配位数为________;列式计算晶体F的密度(g·cm-3)________。
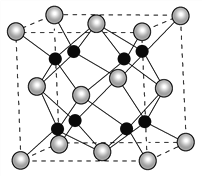
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质或应用的说法不正确的是
A.二氧化硅是生产光纤制品的基本原料
B.水玻璃可用于生产黏合剂和防火剂
C.Na2O、Na2O2与CO2反应产物相同
D.SiO2是酸性氧化物,能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);基态D原子的电子排布式为______________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC![]() 的空间构型为________(用文字描述)。
的空间构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比________。

(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明的溶液中,能大量共存的离子组是( )
A. Na+、H+、SO42-、HCO3- B. Na+、K+、Cl-、NO3-
C. Cu2+、K+、SO42-、NO3- D. Ba2+、K+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)


(1)写出①~④的仪器名称:①__________,②__________,③________,④________。
(2)实验室制取并收集氧气时应选择________和________相连接,制取并收集氢气时应选择________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是__________________________________________________。
(4)制取氢气并做还原氧化铜的实验,应选择________和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com