
【题目】A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);基态D原子的电子排布式为______________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC![]() 的空间构型为________(用文字描述)。
的空间构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比________。

(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________。
【答案】 C<O<N 1s22s22p63s23p63d104s1或[Ar]3d104s1 sp2 平面三角形 2NA(或2×6.02×1023) 1∶5 5 0.083g·cm-3
【解析】本题主要考查元素的性质。
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,A是碳。C是地壳中含量最多的元素,C是氧。B原子的最外层p轨道的电子为半充满结构,B是氮。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,D是铜。
(1)A、B、C的第一电离能由小到大的顺序是C<O<N;基态D原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1。
(2)A的最高价氧化物对应的水化物碳酸分子中,其中心原子碳原子价层电子对是3,采取sp2杂化;NO![]() 的中心原子N的价层电子对是3,空间构型为平面三角形。
的中心原子N的价层电子对是3,空间构型为平面三角形。
(3) CN-中含有三键,其中2个π键,所以1 mol CN-中含有的π键个数为2NA(或2×6.02×1023)。
(4)该合金中Ca和D的原子个数比为1:5。
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,则LaNin中n=5;已知镧镍合金LaNin晶胞体积为(9.0×10-23)cm3,储氢后晶胞中氢的质量(4.5/NA)g,氢在合金中的密度为(4.5/NA)/(9.0×10-23)g·cm-3=0.083g·cm-3。


科目:高中化学 来源: 题型:
【题目】证明溴乙烷中溴元素的存在,下列操作步骤正确的是( )
①加入AgNO3溶液;②加入NaOH水溶液;③加热;④加入蒸馏水⑤加稀硝酸至酸性;⑥加入加入NaOH醇溶液
A. ⑥③⑤① B. ①②③⑤ C. ④⑥③① D. ④③①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于试剂保存的说法中错误的是
A. 浓硝酸保存在棕色试剂瓶中,放阴凉冷暗处
B. 液溴保存在棕色磨口试剂瓶中,并加入少量水密封保存
C. 烧碱溶液保存在用玻璃塞的玻璃试剂瓶中
D. 氢氟酸保存在抗酸塑料瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的镁、铝合金与硝酸恰好完全反应,得到硝酸盐溶液和NO2、N2O4、NO的混合气体,将这些气体与标准状况下3.36 L O2混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸盐溶液中加入2 mol/L NaOH溶液至沉淀最多时停止加入,将沉淀滤出,向滤液中加水稀释至500 mL,此时所得溶液的物质的量浓度为( )
A. 0.5 mol/L B. 1 mol/L
C. 1.2 mol/L D. 2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,能使电离平衡H2O![]() H++OH﹣向右移动,且溶液呈酸性的是( )
H++OH﹣向右移动,且溶液呈酸性的是( )
A. 向水中加入NaHSO4溶液 B. 向水中加入Na2CO3溶液
C. 向水中加入Al2(SO4)3固体 D. 将水加热到100℃,使pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置制取乙酸乙酯.
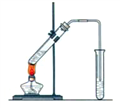
(1)浓硫酸的作用①________;②__________
(2)右边收集试管内装有__________,该溶液的作用是:
①________________②_____________③____________。
(3)实验生成的乙酸乙酯其密度比水____(填“大”或“小”),有____气味.
(4)制取乙酸乙酯的反应方程式是:_______________________________________
(5)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物是____(填物质的名称).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数___________。
(2)混合后溶液的物质的量浓度_____________。
(3)在1000g水中需溶解_____________摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com