
工业上常用电解熔融氯化钠的方法制取金属钠和氯气,试回答下列问题:
(1)金属钠在________极上产生.
(2)写出产生Cl2的电极反应方程式:________.
(3)该反应________(填“是”或“不是”)离子反应,如果是,请写出该反应的离子方程式________(如不是,则此空不填).
(4)为何不采用电解食盐水来制取钠________.
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解




| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
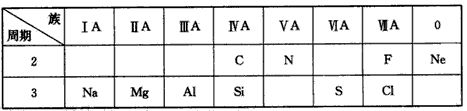
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | C | N | F | Na | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
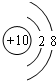
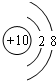
 代表氢原子代表
代表氢原子代表  碳原子),
碳原子),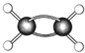 该有机物中碳元素与氢元素的质量比m(C):m(H)=
该有机物中碳元素与氢元素的质量比m(C):m(H)=
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建福清东张中学高二上学期期中考试文科化学试卷(带解析) 题型:填空题
(l2分)下表是元素周期表的一部分,根据所给的10 种元素,回答下列
问题。
(1)非金属性最强的元素是 ;
(2)Ne 原子结构示意图为 ;
(3)C 与N 中,原子半径较小的是 ;
(4)氯水具有漂白作用,是由于其中含有 (填“HCl”或“HClO”)
(5)元素最高价氧化物对应的水化物中,碱性最强的是 (填化学式),呈两性的是 (填化学式);
(6)元素硅的氧化物常用于制造 (填一种高性能的现代通讯材料的
名称);
(7)右图 为某有机物的球棍模型(其中
为某有机物的球棍模型(其中 代表氢原子代表
代表氢原子代表 碳原子),该有机物中碳元素与氢元素的质量比m(C):m(H)= 。(相对原子质量C-12、H-l)
碳原子),该有机物中碳元素与氢元素的质量比m(C):m(H)= 。(相对原子质量C-12、H-l)
(8)镁是制造汽车、飞机、火箭的重要材料。写出工业上电解熔融氯化镁获得金属镁的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:0113 会考题 题型:填空题
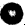 代表碳原子),该有机物中碳元素与氢元素的质量比m(C):m(H)=____(相对原子质量C-12、H-1)。
代表碳原子),该有机物中碳元素与氢元素的质量比m(C):m(H)=____(相对原子质量C-12、H-1)。 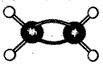
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com