
在2L密闭容器内,800℃时反应2NO(g)+O2(g)
 2NO2(g)△H=a KJ·mol-1体系中,n(NO)随时间变化如下表:
2NO2(g)△H=a KJ·mol-1体系中,n(NO)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= 。已知:K(300℃)>K(350 ℃),
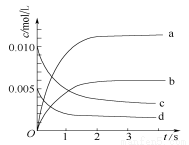 则a 0(填>,<或=)。
则a 0(填>,<或=)。
(2)用NO表示从0~2 s内该反应的平均速率v(NO)= 。
科目:高中化学 来源:2016届浙江省东阳市高三上学期12月月考化学试卷(解析版) 题型:选择题
设NA为的值,下列叙述正确的是
A.常温下,1L 0.1mol·L-1的NH4NO3溶液中氮原子数为0.2NA
B.1 mol羟基中电子数为10 NA
C.在反应KIO3 + 6HI = KI + 3I2 + 3H2O中,每生成3 mol I2 转移的电子数为6 NA
D.常温常压下,22.4L乙烯中C--H键数为4 NA
查看答案和解析>>
科目:高中化学 来源:2016届浙江省富阳市高三上学期第二次质检化学试卷(解析版) 题型:选择题
下列有关物质的性质与其应用不相对应的是
A.MgO、Al2O3的熔点很高,可制作耐高温材料
B.NaHCO3能与碱反应,食品工业上用作焙制糕点的膨松剂
C.Al具有良好的延展性和抗腐蚀性,可制成铝箔包装物品
D.利用钠蒸气放电发光的性质制造的高压钠灯,可发出射程远、透雾能力强的黄光
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期月考(三)化学试卷(解析版) 题型:选择题
设NA代表阿伏伽德罗常数的数值,则下列说法正确的是( )
A.常温常压下,1mol氦气含有的核外电子数为4NA
B.0.25mol Na2O2中含有的阴离子数为0.5NA
C.50ml 18.4mol/L浓硫酸与足量铜微热,生成气体0.46NA
D.25℃时,7g C2H4和C3H6的混合气体中,含有NA个C—H键
查看答案和解析>>
科目:高中化学 来源:2016届山东师大附中高三上学期第二次模拟考试化学试卷(解析版) 题型:填空题
本题有两部分
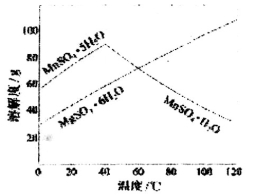
I:软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O,反应的化学方程式为:MnO2+SO2=MnSO4
(1)质量为17.4g纯净MnO2最多能氧化____________L(标准状况)SO2。
(2)上述反应制得的溶液,调节pH值到5~7的范围,以除去Fe3+、 Al3+(使其浓度小于l×10-6mol·L-1),然后从得到的MnSO4和 MgSO4混合溶液中结晶MnSO4·H2O晶体,下图可以看出,需控制结晶温度在_______以上。
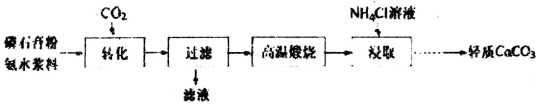
II:以磷石膏(主要成分CaSO4,杂质SiO2、A12O3等)为原料可制备轻质CaCO3。
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见下图。清液pH>11时CaSO4转化的离子方程式_______________________
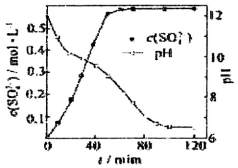
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为SO42-和_______(填化学式);检验洗涤是否完全的方法是____________。
(3)磷石膏若用氢氧化钠溶液溶解,发生反应的有关离子方程式为:
_________________________________ 、____________________________________
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上学期期中测试化学试卷(解析版) 题型:选择题
某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g)  Z(g)+W(s) ΔH>0。下列叙述中,正确的是:
Z(g)+W(s) ΔH>0。下列叙述中,正确的是:
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.改变条件,又达新平衡,此时上述反应的平衡常数K值一定增大
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三12月月考化学试卷(解析版) 题型:选择题
下列有关结构和性质的说法中,正确的是 ( )
A.Si、P、S、 Cl元素的单质与氢气化合越来越剧烈
B.元素原子的最外层电子数越多,元素的金属性越强
C.第三周期主族元素从左到右的最高价含氧酸酸性减弱
D.元素中期表共有18列,第8列属于第ⅧB族、第17列属于第ⅫA族
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中测试化学试卷(解析版) 题型:选择题
下列有关金属腐蚀与防护的说法正确的是
A.钢柱在水下部分比在空气与水交界处更容易腐蚀
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川市高三上学期统练(三)化学试卷(解析版) 题型:填空题
氮元素能形成多种多样的化合物。
(1)己知N2O4 (g) 2NO2 (g) ΔH=+57.20 kJ/mol ,t℃时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
2NO2 (g) ΔH=+57.20 kJ/mol ,t℃时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
①c(X)代表 (填化学式)的浓度,该反应的平衡常数K= 。
②20 min时改变的条件是 ;重新达到平衡时,N2O4的转化率将 (填选项前字母)。
a.增大 b.减小 c.不变 d.无法判断
③t℃时,下列情况不能说明该反应处于平衡状态的是 ;
A.混合气体的密度保持不变 B.混合气体的颜色不再变化
C.混合气体的气体压强保持不变 D.N2O4与NO2的物质的量比为10:3
④若反应在t℃进行,某时刻测得n(NO2)=0.6 mol、n(N2O4)=1.2mol,则此时v(正) v(逆)(填 “>” 、“<”或“=”)。
(2)已知2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l) ΔH= -1225 kJ/mol
化学键 | N-H | N-N | N≡N | O-H |
键能(kJ/mol) | 390 | 190 | 946 | 460 |
则使1 mol N2O4 (l)完全分解成相应的原子时需要吸收的能量是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com