
【题目】某有机物是药物生产的中间体,其结构简式如图。下列有关叙述正确的是( )

A. 该有机物能与溴水发生加成反应
B. 该有机物与浓硫酸混合加热可发生消去反应
C. 1 mol 该有机物与足量NaOH溶液反应最多消耗3 mol NaOH
D. 该有机物经催化氧化后能发生银镜反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.车用燃料技术的研究受到广泛关注,目前利用氢能的氢氧燃料电池技术较成熟。某兴趣小组想探究氢氧燃料电池反应的工作原理,设计如图(a)所示的实验装置。实验前,U 型管中装满溶液,电极均为铂电极。
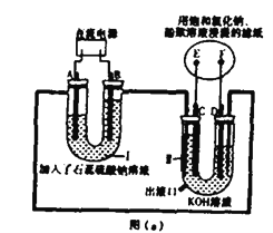
(1)I池为______(填“原电池”、“电解池”),判断A、B的电极名称的依据是:__________ B极的电极反应式:__________
(2)通电一段时间后,滤纸上发生明显颜色变化,则发生反应的化学方程式为___________
(3)Ⅱ池中电极具有导电和_______的作用,写出D的电极反应式:___________
Ⅱ.该兴趣小组查阅资料发现,现有的技术在原料氢气的储存和运输方面都存在安全隐患.2017年3月大连理工大学研究以“铂一碳化钼催化甲醇和水液化重组制备氢气”的新方法获得重大突破,并在美国《自然》杂志发表,具体原理如上图(b)所示:
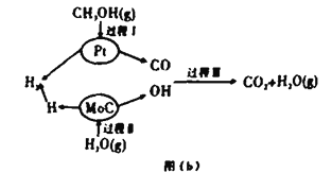
(4)过程Ⅱ属于_________(填“吸热”或“放热)过程。
(5)依据下表完成总反应的热化学方程式:____________
化学键 | C=O | H-H | C-O | H-O | C-H |
E/(kJ/mol) | 803 | 436 | 326 | 464 | 414 |
(6)天然气是一种清洁的化石燃料.也可以在一定的条件下与水反应产生CO2和H2,若生产等量氢气,则消耗甲醇和甲烷的质量比为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下图分析,下列结论正确的是_____。
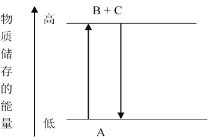
A.A→B+C,B+C→A,两个反应吸收或放出的能量相等
B.A→B+C是放热反应
C.A→B+C是吸热反应
D.A具有的能量高于B+C的能量总和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅单质及其化合物的说法正确的是
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、陶瓷都是硅酸盐产品
③高纯度的硅单质广泛用于制作光导纤维
④普通玻璃是氧化物,成分可表示为SiO2
⑤粗硅制备单晶硅不涉及氧化还原反应
A. ①② B. ①②③ C. ①②③④ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是
A. 1 mol羟基中含有l0NA个电子
B. 常温下,22.4 L CH4在O2中完全燃烧,生成NA个CO2分子
C. 标准状况下,18 g H2O中所含的氧原子数为NA
D. 0.2 mol L-1的NH4Cl溶液中含有0.2NA个NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.阴阳离子之间通过静电引力形成的化学键,叫离子键
B.在共价化合物中不可能含有离子键
C.含有共价键的化合物一定是共价化合物
D.含有离子键的化合物不一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知软锰矿和锰结核矿的主要成分均为MnO2,二氧化锰的制备和性质在生产生活和化学实验中有广泛应用。
二氧化锰的制备:
锰粉的主要成分为NH4Cl、C和MnO2,将锰粉进行如图所示操作后,可得到二氧化锰固体。

(1)某同学认为试剂a为蒸馏水,你认为______(填“能”或“不能”)实现实验目的。
(2)操作1的名称是______,所用到的玻璃仪器有烧杯、玻璃棒和______。
(3)在空气中充分灼烧的目的是_________。
二氧化锰的性质检验:
Ⅰ.氧化性
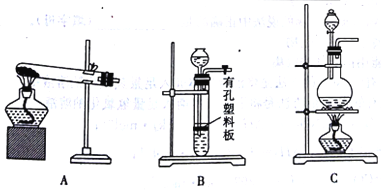
(4)实验室用MnO2与浓盐酸反应制备Cl2,可以选用的装置是______(填字母)。
(5)将MnO2放在NH3气流中加热,可得到棕黑色的Mn2O3和N2,该反应的化学方程式为_______。
Ⅱ.还原性
(6)下列流程所发生的反应中,氧化剂与还原剂的物质的量之比为______。
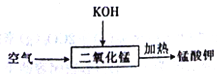
Ⅲ.催化性
MnO2是实验室制取O2的催化剂。某同学设计实验探究双氧水分解的实验方案如下表所示。
实验序号 | w(H2O2)/% | 粉状MnO2/g | 温度/℃ | 待测数据 |
① | 5 | 0 | 20 | |
② | 5 | 1.0 | 20 |
(7)本实验的待测数据是___________。
(8)由实验①和②可得出的结论是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成。B、C的组成元素相同,其化学式都可表示为Z2X2Y![]() ,且C的摩尔质量比B大80g/
,且C的摩尔质量比B大80g/![]() ,请回答:
,请回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为_________(填字母代号)
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)下表为B与F实验的部分内容:
①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
②向20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出B与稀H2SO4反应的离子方程式______________________;
写出②中反应方程式___________________________。
(3)现由6种粒子![]() (C中含有的阴离子)、
(C中含有的阴离子)、![]() 完成一个离子方程式,已知
完成一个离子方程式,已知![]() 为还原剂,则得到
为还原剂,则得到![]() 需氧化剂的物质的量为_______
需氧化剂的物质的量为_______![]() .
.
(4)化合物D和E相互转化D![]() E,若有D和
E,若有D和![]() 的混合物13.04g,加热到完全反应后,气体产物通过浓
的混合物13.04g,加热到完全反应后,气体产物通过浓![]() 增重3.42g,剩余气体通过碱石灰增生2.20g,则
增重3.42g,剩余气体通过碱石灰增生2.20g,则![]() 的化学式为__________________________.
的化学式为__________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com