
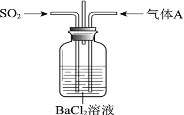
【题目】将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体A,则产生白色沉淀。制备气体A的试剂不能是
A. 大理石和稀盐酸
B. NaOH和NH4Cl
C. Cu和浓硝酸
D. MnO2和浓盐酸
【答案】A
【解析】
由强酸制弱酸的原理可知,SO2与BaCl2溶液不反应,不可能生成BaSO3沉淀,通入另一种气体产生白色沉淀,应有两种情况,一是溶液中有较多的SO32-离子,或发生氧化还原反应生成SO42-离子,否则不生成沉淀。
A项、大理石和稀盐酸制得二氧化碳气体,二氧化碳和二氧化硫与氯化钡均不反应,不会产生沉淀物,故A正确;
B项、NaOH和NH4Cl共热反应生成氨气,通入氨气溶液呈碱性,溶液中生成大量的SO32-离子,生成沉淀BaSO3,故B错误;
C项、Cu和浓硝酸生成二氧化氮气体,NO2与水反应生成具有氧化性的硝酸,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,故C错误;
D项、MnO2和浓盐酸共热反应生成氯气,Cl2具有氧化性,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,故D错误。
故选A。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】从某些反应看,NH3和H2O、NH4+和H3O+、NH![]() 和OH-、N3-和O2-两两类似。据此判断下列反应正确的是
和OH-、N3-和O2-两两类似。据此判断下列反应正确的是
①CaO+2NH4Cl===CaCl2+2NH3↑+H2O ②2Na+2NH3===2NaNH2+H2↑
③3Mg(NH2)2===Mg3N2+4NH3↑ ④NH4Cl+NaNH2===NaCl+2NH3↑
A. 只有③ B. 只有① C. ①和② D. 都正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)已知R2-离子的核内有n个中子,R的质量数为M,则mg R2-离子里含有电子的物质的量为 ____________mol。
(2)X元素最高价氧化物对应的水化物为H3XO4,则它对应的气态氢化物为_____ 。
(3)已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则元素非金属性由强到弱顺序为:____________ ;气态氢化物的稳定性由强到弱顺序为:______________ 。
(4).甲、乙两种非元素:①甲比乙容易与H2化合;②甲原子能与乙的阴离子发生置换反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低。
能说明甲的非金属性比乙的非金属性强的有________________
(5)下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
实验序号 | 金属质量/g | 金属状态 | c(H2SO4) mol/L | 实验温度/℃ | 金属消失的时间/s |
1 | 0.10 | 丝 | 0.7 | 25 | 240 |
2 | 0.10 | 丝 | 1.0 | 25 | 190 |
3 | 0.10 | 粉末 | 1.0 | 25 | 120 |
4 | 0.10 | 粉末 | 1.0 | 40 | 40 |
分析上述数据,回答下列问题:
①实验1、
②实验2、3可得出的结论是_________________________。
③实验3、4可得出的结论是______________________。
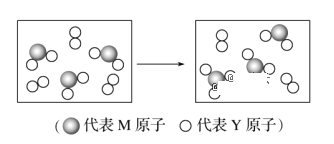
(6)下图表示由M、Y两元素组成的两种气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用洗净的废铜屑做原料来制备硝酸铜,从节约原理及防治污染环境的角度考虑,宜采取的方法是
A. Cu+HNO3(浓)→Cu(NO3) 2
B. Cu+HNO3(稀)→Cu(NO3) 2
C. Cu ![]() CuO
CuO ![]() Cu(NO3)2
Cu(NO3)2
D. Cu ![]() CuSO4
CuSO4 ![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A. 12C、13C、14C是碳的三种同素异形体
B. H2S的电子式可表示为![]()
C. HCl、HBr、HI的稳定性逐渐减弱,而熔沸点逐渐升高
D. NaHSO4在熔融状态下不仅破坏了离子键,还破坏了共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S2O3是一种弱酸,实验室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为:I2+2Na2S2O32NaI+Na2S4O6,下列说法合理的是( )
A. 该滴定可选用如图所示装置示剂;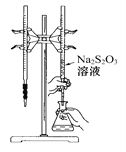
B. 该滴定可用甲基橙作指;
C. Na2S2O3是该反应的还原剂;
D. 该反应中每消耗2 mol Na2S2O3,电子转移数为4 mol;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。
I.(1)海水中所得粗盐中通常含Ca2+、Mg2+、SO42-等杂质,为了得到精盐,下列试剂加入的先后顺序正确的是________
A.BaCl2→Na2CO3→NaOH→HCl B.NaOH→BaCl2→Na2CO3→HCl
C.BaCl2→NaOH→Na2CO3→HCl D. Na2CO3→NaOH→BaCl2→HCl
(2)为了检验精盐中是否含有SO42-,正确的方法是____________________________。
II.海藻中提取碘的流程如图所示
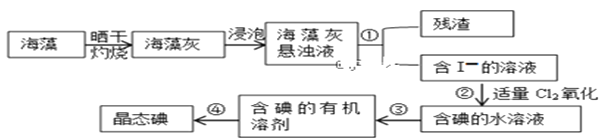
(3)灼烧过程中,需使用到的(除泥三角外)实验仪器有____________
A.试管 B.瓷坩埚 C.坩埚钳 D.蒸发皿 E.酒精灯 F.三脚架
(4)指出提取碘的过程中有关实验操作名称:①________③__________④_________
(5)步骤②反应的离子方程式为___________________,该过程氧化剂也可以用H2O2,将等物质的量的I-转化为I2,所需Cl2和H2O2的物质的量之比为__________
(6)下列关于海藻提取碘的说法,正确的是_________
A.含碘的有机溶剂呈现紫红色
B.操作③中先放出下层液体,然后再从下口放出上层液体
C.操作④时,温度计的水银球应伸入液面以下但不能触碰到蒸馏烧瓶的底部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁高效能源,以甲醇为原料可以制取氢气。回答下列问题:
(1)甲醇水蒸气重整制氢
主反应:①CH3OH(g)![]() CO(g)+2H2(g) ΔH =+90.7kJ/mol
CO(g)+2H2(g) ΔH =+90.7kJ/mol
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH =-41.2 kJ/mol
CO2(g)+H2(g) ΔH =-41.2 kJ/mol
副反应:③CO(g)+3H2(g)![]() CH4(g)+H2O(g) ΔH =+206.3 kJ/mol
CH4(g)+H2O(g) ΔH =+206.3 kJ/mol
则甲醇水蒸气重整制氢反应(反应Ⅰ):CH3OH(g) +H2O(g)![]() CO2(g)+3H2(g)的 ΔH=_________。反应②中lmolCO与lmol水蒸气反应的的活化能为E1kJ,则该反应生成物的活化能为_________kJ。
CO2(g)+3H2(g)的 ΔH=_________。反应②中lmolCO与lmol水蒸气反应的的活化能为E1kJ,则该反应生成物的活化能为_________kJ。
(2)实验室模拟甲醇水蒸气重整制氢过程,合成器组成n(CH3OH):n(H2O) =1:1时,体系中甲醇的平衡转化率与温度和压强的关系如图所示。

①该反应的平衡常数表达式为_______________。
②当温度为250℃、压强为P2时,反应达平衡时H2的体积分数为______________。
③图中的压强由小到大的顺序是________________。
④根据主副反应分析,氢气的产率随压强的增大而___________,其原因是__________________。
(3)MFC30氢氧燃料电池是以碳酸盐为电解质(提供CO32-)的高温型燃料电池,负极的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选用金属材料时,以下方面需要考虑的是( )
①主要用途 ②物理性质、化学性质 ③价格 ④加工难度 ⑤日常维护 ⑥对环境的影响
A.①②③B.③④⑤C.①⑤⑥D.①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com