
【题目】海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。
I.(1)海水中所得粗盐中通常含Ca2+、Mg2+、SO42-等杂质,为了得到精盐,下列试剂加入的先后顺序正确的是________
A.BaCl2→Na2CO3→NaOH→HCl B.NaOH→BaCl2→Na2CO3→HCl
C.BaCl2→NaOH→Na2CO3→HCl D. Na2CO3→NaOH→BaCl2→HCl
(2)为了检验精盐中是否含有SO42-,正确的方法是____________________________。
II.海藻中提取碘的流程如图所示
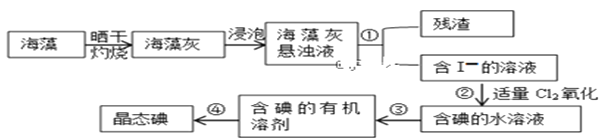
(3)灼烧过程中,需使用到的(除泥三角外)实验仪器有____________
A.试管 B.瓷坩埚 C.坩埚钳 D.蒸发皿 E.酒精灯 F.三脚架
(4)指出提取碘的过程中有关实验操作名称:①________③__________④_________
(5)步骤②反应的离子方程式为___________________,该过程氧化剂也可以用H2O2,将等物质的量的I-转化为I2,所需Cl2和H2O2的物质的量之比为__________
(6)下列关于海藻提取碘的说法,正确的是_________
A.含碘的有机溶剂呈现紫红色
B.操作③中先放出下层液体,然后再从下口放出上层液体
C.操作④时,温度计的水银球应伸入液面以下但不能触碰到蒸馏烧瓶的底部
【答案】ABC 取少量精盐溶于水,先加入稀盐酸,无现象,向其中加入氯化钡溶液,若产生沉淀,则含有硫酸根离子 BCEF 过滤 萃取分液 蒸馏 Cl2+2I-![]() 2Cl-+I2 1:1 A
2Cl-+I2 1:1 A
【解析】
I.海水中所得粗盐中通常含Ca2+、Mg2+、SO42-等杂质,为了得到精盐,Ca2+用碳酸钠转化为沉淀、Mg2+用NaOH转化为沉淀、SO42-用氯化钡溶液转化为沉淀,先除去Mg2+或SO42-,然后再加入过量的碳酸钠除去Ca2+以及过量的Ba2+杂质,过滤后再加盐酸除去过量的NaOH和碳酸钠;关键点:根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去;检验硫酸根离子一定要防止其他离子干扰;
II.将海藻晒干,放到坩埚中灼烧得到海藻灰,海藻灰悬浊液过滤除掉残渣,得到含碘离子的溶液,通入氯气将碘离子氧化为碘单质,加入有机试剂苯或四氯化碳将碘单质萃取到有机层,分液得有机溶液,再蒸馏得到晶态碘;
(3)固体灼烧用到的仪器有坩埚,坩埚钳,泥三角,三脚架,酒精灯;
(4)海藻灰悬浊液过滤除掉残渣,得到含碘离子的溶液,通入氯气将碘离子氧化为碘单质,加入有机试剂苯或四氯化碳将碘单质萃取到有机层,分液得有机溶液,再蒸馏得到晶态碘;
(5)选择氧化剂将碘离子氧化为碘单质,根据得失电子数相等计算;
(6)A.碘单质在有机溶剂中呈现紫红色;
B.没有确定萃取剂是谁,没有办法确定有机溶液在上层还是下层;
C.温度计的水银球应该在蒸馏烧瓶支管口附近测量蒸气的温度;
I.(1)根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去的原则确定除杂顺序,所以碳酸钠必须在氯化钡后面,过滤后再加盐酸除去过量的NaOH和碳酸钠,选项A、B、C满足;
正确答案:ABC。
(2)检验硫酸根离子,应该先加入盐酸无现象,排除其他杂志离子的干扰,再加入氯化钡产生白色沉淀;
正确答案:少量精盐溶于水,先加入稀盐酸,无现象,向其中加入氯化钡溶液,若产生沉淀,则含有硫酸根离子。
II. 现将海藻晒干,放到坩埚中灼烧得到海带灰,海藻灰悬浊液过滤除掉残渣,得到含碘离子的溶液,通入氯气将碘离子氧化为碘单质,加入有机试剂苯或四氯化碳将碘单质萃取到有机层,分液得有机溶液,再蒸馏得到晶态碘;
(3)固体灼烧用到的仪器有坩埚,坩埚钳,泥三角,三脚架,酒精灯;
正确答案:BCEF。
(4)海藻灰悬浊液过滤除掉残渣,得到含碘离子的溶液,通入氯气将碘离子氧化为碘单质,加入有机试剂苯或四氯化碳将碘单质萃取到有机层,分液得有机溶液,再蒸馏得到晶态碘;
正确答案:过滤 萃取分液 蒸馏。
(5)Cl2+2I =2Cl-+I2,2I-+H2O2+2H+=I2+2H2O,将等物质的量的I-转化为I2,所需Cl2和H2O2的物质的量之比1:1;
正确答案:Cl2+2I =2Cl-+I2 1:1。
(6)A.碘单质在有机溶剂中呈现紫红色,故A正确;
B.没有确定萃取剂是谁,没有办法确定有机溶液在上层还是下层,故B不正确;
C.温度计的水银球应该在蒸馏烧瓶支管口附近测量蒸气的温度,故C不正确;
正确答案:A。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置进行铁与水蒸气反应的实验,并检验产物的性质,请回答下列问题:
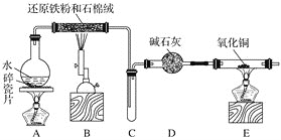
(1)A装置的作用是____________,烧瓶底部放碎瓷片的作用是_________________________。
(2)装置B中发生反应的化学方程式是____________________________________,该反应中氧化剂是__________,氧化产物是__________________。
(3)D的作用是__________________________________。
(4)E中的实验现象是____________________________。
(5)A、B两个装置中应先点燃________________处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作能够达到实验目的的是
|
|
|
|
A.验证一定生成SO2 | B. 用排空气法收集NO | C. 制取并检验氨气 | D.用水吸收氨气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体A,则产生白色沉淀。制备气体A的试剂不能是
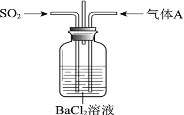
A. 大理石和稀盐酸
B. NaOH和NH4Cl
C. Cu和浓硝酸
D. MnO2和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是 ( )
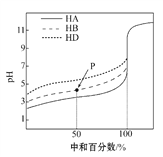
A. 三种酸的电离常数关系:KHA>KHB>KHD
B. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
C. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)= c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质)。实验室利用毒重石制备BaCl2·2H2O的流程如下:
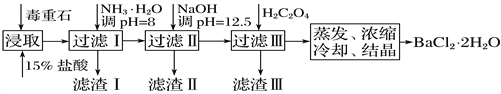
(1)毒重石用盐酸浸取前需充分研磨,目的是_________________________。
(2)已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
加入NH3·H2O调pH=8可除去________(填离子符号),滤渣Ⅱ中含__________(填化学式)。加入H2C2O4时应避免过量,原因是______________________________。
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+=Cr2O72-+H2O;Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的________(填“上方”或“下方”)。BaCl2溶液的浓度为_______mol·L-1。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在做氨的催化氧化实验时,铂丝不能接触氨水,原因是( )
A.铂丝温度高,接触氨水会使氨气大量逸出
B.防止铂丝温度降低而不能起催化作用
C.红热铂丝会与氨水反应,使铂丝腐蚀
D.防止爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在下列晶体中:①NaOH、②Na2S、③(NH4)2S、④Na2O2、⑤C2H2、⑥SiC。其中既含有离子键又含有非极性共价键的离子晶体是__________;其中既含有离子键,又含有极性共价键和配位键的离子晶体是___________;其中含有极性共价键和非极性共价键的非极性分子是____________;其中属于原子晶体的是____________;
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
① 与Fe原子或离子形成配合物的分子或离子都具备的结构特点是_______________;
② 六氰合亚铁离子【Fe(CN)6】4-中的配体CN-中C原子的杂化轨道类型是________,写出一种与CN互为等电子体的单质分子的结构式_______;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚.丙酮等有机溶剂。据此判断三氯化铁晶体类型为_________________;
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为_______________________。
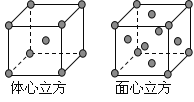
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关胶体的叙述正确的是( )
A. 直径介于1-100nm之间的微粒称为胶体
B. 有色玻璃、雾都不是胶体
C. 涂料、颜料、墨水的制造,明矾净水和胶体有关
D. 硅酸胶体加入过量的氢氧化钠溶液由于胶体聚沉而形成硅酸沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com