
【题目】最外层电子排布式为3s23p3的原子,其核外电子占有的轨道数为( )
A.4B.7C.8D.9
科目:高中化学 来源: 题型:
【题目】X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X是周期表中半径最小的元素,Y的氧化物是形成酸雨的主要物质之一.请回答:
(1)Q元素在周期表中的位置 . J的离子的结构示意图为 .
(2)这五种元素原子半径从大到小的顺序为(填元素符号).
(3)元素的非金属性:ZQ(填“>”或“<”),下列各项中,不能说明这一结论的事实有 .
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.X2Z的稳定性比X2Q强
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与Z的单质反应的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生反应: NO2(g)+SO2(g)![]() SO3(g)+NO(g)ΔH=-41.8kJ/mol,下列能说明反应达到平衡状态的是
SO3(g)+NO(g)ΔH=-41.8kJ/mol,下列能说明反应达到平衡状态的是
A. 体系压强保持不变 B. 混合气体颜色保持不变
C. SO3和NO的体积比保持不变 D. 每消耗1 mol SO3的同时生成1 mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血红蛋白中含有Fe2+,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转变为Fe3+,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
A.酸性B.碱性C.氧化性D.还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
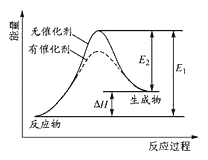
(1)某反应的反应过程中能量变化如图所示,回答下列问题:
E逆反应的活化能___E反应的活化能(填“大于”或“小于”)
(2)50mL 0.50mol/L盐酸与50mL 0.55mo/L NaOH溶夜在如图所示的装置中进行中和反应,逋过测定反应过程中所放出的热量可计算中和热,回答下列问题:
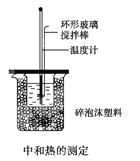
①烧杯间填满碎泡沫塑料作用是________
②实验中改用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等“或“不相等”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列广告语对应商品中含有的物质有误的是
A.“红梅味精,领先(鲜)一步”——蛋白质
B.“衡水老白干,喝出男人味”——酒精
C.“吃了钙中钙,腰不疼了,腿不痛了,腰杆也直了”——碳酸钙
D.“要想皮肤好,早晚用大宝”——甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2和N2O4可以相互转化:2NO2(g) ![]() N2O4(g)(正反应为放热反应)。现将一定
N2O4(g)(正反应为放热反应)。现将一定
量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示,回答下列问题:

(1)图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是________。
(2)前10 min内用NO2表示的化学反应速率v(NO2)=________mol/(L·min);反应进行至25 min时,曲线发生变化的原因是________。
(3)若要达到与最后相同的化学平衡状态,在25 min时还可以采取的措施是________。
A.加入催化剂 B.缩小容器体积
C.升高温度 D.加入一定量的N2O4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com