
分析 X的分子式为C6H12O2,X在酸性条件下与水反应,生成两种有机物Y和Z,可知X应为酯,Y在铜催化下被氧化为W,W被氧化为Z,则Y和Z的碳原子数相对,Y为CH3CH2CH2OH,W为CH3CH2CHO,Z为CH3CH2COOH,X应为CH3CH2COOCH2CH2CH3,以此解答该题.
解答 解:X的分子式为C6H12O2,X在酸性条件下与水反应,生成两种有机物Y和Z,可知X应为酯,Y在铜催化下被氧化为W,W被氧化为Z,则Y和Z的碳原子数相对,Y为CH3CH2CH2OH,W为CH3CH2CHO,Z为CH3CH2COOH,X应为CH3CH2COOCH2CH2CH3,
(1)由以上分析可知X为酯类物质,含有酯基,W为丙醛,还含有的官能团为-CHO,故答案为:酯基;-CHO;
(2)由以上分析可知X为CH3CH2COOCH2CH2CH3,故答案为:CH3CH2COOCH2CH2CH3;
(3)①Y为CH3CH2CH2OH,与浓硫酸的混合物共热发生消去反应生成CH3CH=CH2,方程式为CH3CH2CH2OH$→_{△}^{浓硫酸}$CH3CH=CH2+H2O,故答案为:CH3CH2CH2OH$→_{△}^{浓硫酸}$CH3CH=CH2+H2O;
②W为CH3CH2CHO,与新制银氨溶液发生氧化反应,反应方程式为CH3CH2CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3CH2COONH4+2Ag↓+3NH3+H2O,
故答案为:CH3CH2CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3CH2COONH4+2Ag↓+3NH3+H2O;氧化;
(4)X的某种同分异构体能使石蕊试液变红色,应含有羧基,为C5H11COOH,同分异构体的种类取决于-C5H11的种类,戊基-C5H11可能的结构有:-CH2CH2CH2CH2CH3、-CH(CH3)CH2CH2CH3、-CH(CH2CH3)2、-CHCH(CH3)CH2CH3、-C(CH3)2CH2CH3、-C(CH3)CH(CH3)2、-CH2CH2CH(CH3)2、-CH2C(CH3)3,共8种,
故答案为:8.
点评 本题考查有机物推断,为高频考点,涉及醇、醛、羧酸、酯之间的转化,注意有机物Y和Z,Y在铜催化下被氧化为W,W被氧化为Z的反应判断,需要学生熟练掌握官能团性质与转化,题目难度不大.


科目:高中化学 来源: 题型:解答题
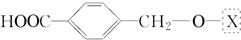 ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.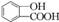 .
. 任意2种.
任意2种.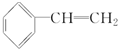 为主要原料制备
为主要原料制备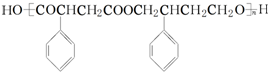 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).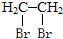
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CO(g)+O2(g)═2CO2(g)△H=-566.0 kJ/mol | |
| B. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ/mol | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31 kJ/mol | |
| D. | 2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l)△H=-11036 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑧ | B. | ④⑤⑦ | C. | ④⑤ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:F2>C12>Br2 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 熔沸点:SiO2>NaCl>CO2 | D. | 热稳定性:SiH4>PH3>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
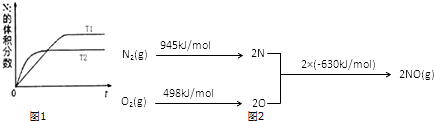
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| 无催化剂不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂加热 | 360 | 480 | t | 720 |
| MnO2催化剂加热 | 10 | 25 | 60 | 120 |
| 催化剂MnO2 | 操作情况 | 观察结果 | 反应完成所需时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com