
【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25 ℃,1.01×105 Pa时,实验测得,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则表示H2的燃烧热的热化学方程式为______________________。
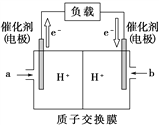
(2)上图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从________处通入(填“a”或“b”),电池内部H+向_______(填“左”或“右”)移动。写出电池负极的电极反应式________。正极的电极反应式_______________________。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H—H | N—H | N≡N |
键能/kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)===2NH3(g) ΔH=-93 kJ·mol-1。
试根据表中所列键能数据计算a的数值________。
当可逆反应中净生成N—H物质的量为2mol 时,反应放热_____________。
(4)已知:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)===C2H2(g)的ΔH=________。
【答案】 H2(g)+![]() O2(g)===H2O(l) ΔH=-286 kJ/mol a 右 2CH3OH+2H2O-12e-===2CO2+12H+ 3O2+12e-+12H+=== 6H2O 391 31 kJ +226.7 kJ·mol-1
O2(g)===H2O(l) ΔH=-286 kJ/mol a 右 2CH3OH+2H2O-12e-===2CO2+12H+ 3O2+12e-+12H+=== 6H2O 391 31 kJ +226.7 kJ·mol-1
【解析】(1)4 g氢气即2mol氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,由于在一定条件下,1mol可燃物完全燃烧生成稳定氧化物时所放出的热量是燃烧热,则表示H2的燃烧热的热化学方程式为H2(g)+1/2O2(g)=H2O(l) ΔH=-286 kJ/mol;(2)原电池中电子从负极经外电路流向正极,根据电子流向可知a电极为负极,甲醇在负极上发生氧化反应,氢离子移向正极右侧,电极反应式为2CH3OH+2H2O-12e-=2CO2↑+12H+,正极是氧气得到电子,电极反应式为3O2+12e-+12H+=6H2O;(3)N2(g)+3H2(g)=2NH3(g)的△H=945kJmol-1+436kJmol-1×3-akJmol-1×6=-93kJmol-1,a=391 kJmol-1;(4)已知:
①C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol-1
③2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1
利用盖斯定律将①×2+②×1/2-③×1/2可得:2C(s,石墨)+H2(g)=C2H2(g)△H=(-393.5kJ/mol)×2+0.5×(-571.6kJ/mol)-0.5×(-2599 kJ/mol)=+226.7kJmol-1。


科目:高中化学 来源: 题型:
【题目】成都七中化学兴趣小组在实验室制备 1,2-二溴乙烷,能使用的药品有乙醇、Br2 的 CCl4溶液以及浓硫酸等。反应装置如下图所示:

有关数据列表如下:

回答下列问题:
(1)用两个化学方程式表示该实验原理:_____________;_________________
(2)用两个化学方程式表示该实验中可能存在的副反应:______________;______________
(3)装置 A 中使用到了恒压滴液漏斗的目的是:_____。装置 B 的目的是:_____________
(4)为保证 D 中尽可能少出现杂质产物,在装置 C 中应加入_____ (填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.酸性 KMnO4 溶液
(5)将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层(填“上”、“下”); 若产物中有少量副产物乙醚.可用_____的方法除去;
(6)若产物中有少量未反应的 Br2,最好用_____洗涤除去;(填正确选项前的字母) a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.亚硫酸钠溶液
(7)反应过程中应用冷水冷却装置 D,其主要目的是_____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,对其开发利用的部分流程如图所示。

下列说法错误的( )
①试剂1可以选用NaOH溶液
②从苦卤中提取Br2的反应的离子方程式为:2Br - + Cl2=2Cl- + Br2
③工业上,电解熔融MgO冶炼金属镁可减小能耗
④制铝:工业上电解熔融氯化铝来制备铝
⑤制钠:电解饱和NaCl溶液
⑥炼铁:用CO在高温下还原铁矿石中的铁
A. ①③④⑥ B. ②③④⑥
C. ①③④⑥ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有 K+、Fe3+、Cu2+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子,该小组同学取 100 mL 水样进行实验:向样品中先滴加氯化钡溶液,再滴加 1 mol·L-1 盐酸,实验过程中沉淀质量的变化如图所示。下列说法正确的是

A. 水样中一定不存在Fe3+、Cu2+,可能存在Ag+
B. 水样中一定存在CO32-、SO42-、Cl-
C. BC段曲线所表示的离子方程式为CO32-+2H+=H2O+CO2↑
D. 水样中一定存在K+,且c(K+)≥0.6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体物质质量减小的是 ( )
A. 二氧化碳通过Na2O2粉末 B. 镁条在二氧化碳中燃烧
C. CO通过灼热的CuO粉末 D. 将铝粉投入CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用盐酸酸化的FeCl3溶液腐蚀铜制线路板,分别取腐蚀后的滤液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
A.通入过量Cl2:Fe3+、H+、Cu2+、Cl
B.加入过量SO2:Fe3+、H+、Cu2+、![]() 、Cl
、Cl
C.加入过量NaOH溶液:Na+、Fe2+、OH、Cl
D.加入过量CuO:Fe2+、H+、Cu2+、Cl、
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,能证明苯酚的酸性极弱的是 ( )
A. 苯酚的水溶液中加入氢氧化钠溶液,生成苯酚钠
B. 苯酚在空气中容易被氧化为粉红色
C. 苯酚钠溶液中通入二氧化碳后,溶液由澄清变浑浊
D. 浑浊的苯酚溶液加热变澄清
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2CH3COCH3(l)![]() CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数(反应物已转化为产物的物质的量和反应物总物质的量的比)随时间变化的关系曲线(Y-t)如下图所示。下列说法正确的是
CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数(反应物已转化为产物的物质的量和反应物总物质的量的比)随时间变化的关系曲线(Y-t)如下图所示。下列说法正确的是

A. b代表0℃下CH3COCH3的Y-t曲线
B. 反应进行到20min末,CH3COCH3的v (0℃)/v(20℃)的比值大于1
C. 升高温度可以缩短反应达到平衡的时间并能提高反应物转化为生成物的物质的量
D. 从Y=0到Y=0.113,CH3COCH2COH(CH3)2的Δn(0℃)/Δn(20℃)的比值等于1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com