
���й�������Ѷ2012��8��23�ձ���������ӵ�س���������������Ҫ�ɷ�ΪLiCoO2 ����������������ӽṹ��̼�������Ϊ�ܴ���Li���ĸ߷��Ӳ��ϣ����ʱ�����ڵ�������ĵ�����ʹ�����Ļ������ͳ�����ӣ�Ƕ�븺���������г�Ƭ��ṹ��̼�У���������ӵ�صĵ�ط�ӦΪ��Li(C)+LiCoO2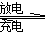 Li2CoO2������˵������ȷ����
Li2CoO2������˵������ȷ����
A���õ�����ڶ��ε��
B�����ʱLiCoO2 �ȷ���������Ӧ�ַ�����ԭ��Ӧ
C�������������֮��ĵ���ʣ����˱����ȶ�������Ҫ�������õ����ԣ���С�������
D���ŵ������Li�����ƶ�
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��12 ���ͣ�ѡ����
�л���ѧ�����ʵĽṹ���ü���ʽ��ʾ����CH2===CHCH2Br�ɱ�ʾΪ ����ѧ�����ϳɾ��ж��ؽṹ�Ļ�����1��2�����ֻ�����1���Ⱥ�ɵû�����2�����¹��ڻ�����1��2��˵����ȷ����
����ѧ�����ϳɾ��ж��ؽṹ�Ļ�����1��2�����ֻ�����1���Ⱥ�ɵû�����2�����¹��ڻ�����1��2��˵����ȷ����
A��������1��2�����ڷ����廯����
B��������1��2��������ˮ��Ӧ��ʹ����ɫ
C��������1��2��Ϊͬ���칹��
D��������1������ԭ�Ӿ�����ͬһƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��10 ���ͣ�ѡ����
����˵����ȷ����
����50mLl8mol��L-1��H2SO4��Һ�м���������ͭƬ���ȳ�ַ�Ӧ����ԭ��H2SO4�����ʵ�������0.45mol
�ڱ�״���£�0.5NA��NO��0.5NA��O2�����������ԼΪ22.4 L
������Һ�е����Ȼ�����Һ���ټ�ϡ�����ܼ�����Һ���Ƿ���SO42-
���ö���������������ʳ��ˮ�͵�����Һ
����ʹAl�ܽ����H2����Һ���ܴ������ڣ�NH4+��Na+��Fe2+��NO3-
A���٢ڢۢ�
B���٢ۢ�
C����
D���ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ�� ���ͣ�ѡ����
2013��CCTV��4������������¶Ⱥ�30��ǰ�������1.5 �����ң�Ϊ��������ЧӦ�����Խ�������̼ת��Ϊ����ԭ�ϣ������ʵ��������£�������̼��������1�U3������Ƚ��з�Ӧ��������ij����Ҫ�Ļ���ԭ�Ϻ�ˮ��������ԭ�ϲ�������
A���״�(CH3OH)������������
B����ϩ��������������
C���Ҵ���������������
D������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ�� ���ͣ�ѡ����
������������ѧ��ѧʵ��Ļ���ʵ�飬���г�ȥ���ʵķ�������ȷ����
A ��ȥ�����е�ˮ����������ͨ��װ�м�ʯ�ҵĸ����
B ��ȥSO2��������SO3���壺����ͨ��ʢŨ�����ϴ��ƿ
C ��ȥCO2��������SO2������ͨ��ʢ����̼������Һ��ϴ��ƿ
D ��ȥ�Ҵ��������������������ʯ�ң�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--�����ۺ�4 ���ͣ������
����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����
������ | ��̿���ڸ��������»�ԭCuO |
������ | ��ⷨ����ӦΪ2Cu + H2O |
������ | ���£�N2H4����ԭ����Cu(OH)2 |
��1����ҵ�ϳ��÷�����ͷ�������ȡCu2O�������÷�������ԭ���Ƿ�Ӧ���������ƣ������²��������� ��ʹCu2O���ʽ��͡�
��2����֪��2Cu(s)��1/2O2(g)=Cu2O(s) ��H =-akJ��mol-1
C(s)��1/2O2(g)=CO(g) ��H =-bkJ��mol-1
Cu(s)��1/2O2(g)=CuO(s) ��H =-ckJ��mol-1
�������ķ�Ӧ��2CuO(s)��C(s)= Cu2O(s)��CO(g)����H = kJ��mol-1��
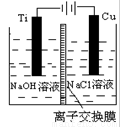
��3��������������ӽ���Ĥ���Ƶ��Һ��OH-��Ũ�ȶ��Ʊ�����Cu2O��װ����ͼ��ʾ���õ�ص���������Cu2O��ӦʽΪ ��
��4��������Ϊ������������Һ̬�£�N2H4����ԭ����Cu(OH)2���Ʊ�����Cu2O��ͬʱ�ų�N2�����Ʒ��Ļ�ѧ����ʽΪ ��
��5������ͬ���ܱ������У����������ַ����Ƶõ�Cu2O�ֱ���д��ֽ�ˮ��ʵ�飺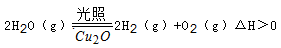
ˮ������Ũ�ȣ�mol/L����ʱ��t(min)�仯���±���ʾ��
��� | �¶� | 0 | 10 | 20 | 30 | 40 | 50 |
�� | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
�� | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
�� | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
����������ȷ���� ������ĸ���ţ���
A��ʵ����¶�T2С��T1
B��ʵ���ǰ20 min��ƽ����Ӧ����v(O2)=7��10-5 mol��L-1 min-1
C��ʵ��ڱ�ʵ������õĴ�����Ч�ʸ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--�����ۺ�2 ���ͣ������
I��800��ʱ�����ݻ�Ϊ2L�ĺ����ܱ������г���һ������CO��H2Oά�ֺ��£�������ӦCO(g)+H2O(g) H2(g)+CO2(g)����Ӧ��???�вⶨ�IJ������ݼ��±���
H2(g)+CO2(g)����Ӧ��???�вⶨ�IJ������ݼ��±���
��Ӧʱ��/min | 0 | 2 | 4 | 6 |
n(CO)/mol | 1.20 | 0.90 |
| 0.80 |
n(H2O)/ mol | 0.60 |
| 0.20 |
|
�ٷ�Ӧ��2 min�ڵ�ƽ������Ϊv(H2O)��__________��
��800��ʱ����ѧƽ�ⳣ��K��ֵΪ______________��
�۱��������������䣬��ƽ����ϵ����ͨ��0.20 mol H2O����ԭƽ����ȣ��ﵽ��ƽ��ʱCOת����______�������С�����䡱����
���ں��º�ѹ�ܱ�������ͨ��CO��H2O��1 mol�����÷�Ӧ������Ӧ�ﵽƽ���ά���¶���ѹǿ���䣬t1ʱ��ͨ���1 mol��CO��H2O�Ļ�����壬������ͼ�л�����(v��)����(v��)��Ӧ������t1����ʱ��t�仯������ͼ��
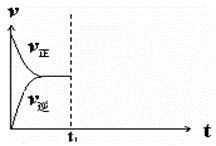
II.ʵ���������ø��ֽⷴӦ��ȡMg(OH)2��ʵ�����ݺ��������±���ʾ����Һ�����ȡ��1mL����
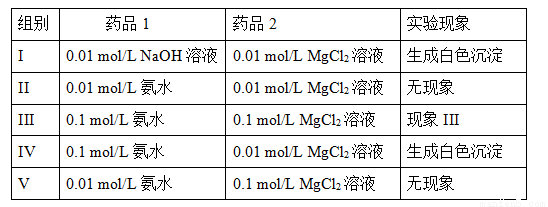
������III�� ��
�������0.028 mol/L��MgCl2��Һ�м���������NaOH��Һ�������NaOH��Һ��Ũ�����ٴﵽ mol/Lʱ����Һ�п�ʼ���ְ�ɫ������Ksp(Mg(OH)2)= 5.6��10-12����
��MgCl2��Һ�Ͱ�ˮ��Ϻ�������л�ѧƽ�⣺
Mg2+(aq) + 2NH3��H2O(aq) 2NH4+(aq) + Mg(OH)2(s)�÷�Ӧ��ѧƽ�ⳣ���ı���ʽΪK= ���г��÷�Ӧƽ�ⳣ��K��Kb(NH3��H2O)��Ksp(Mg(OH)2)�Ĺ�ϵʽ ��
2NH4+(aq) + Mg(OH)2(s)�÷�Ӧ��ѧƽ�ⳣ���ı���ʽΪK= ���г��÷�Ӧƽ�ⳣ��K��Kb(NH3��H2O)��Ksp(Mg(OH)2)�Ĺ�ϵʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014������Ϫһ�С�������ѧ���ݰ�һ�и�һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
25 �桢101 kPa�£���2Na (s)��1/2 O2(g)=== Na2O(s)����H 1 =��414 kJ/mol
��2Na (s)��O2(g)===Na2O2(s)����H2����511 kJ/mol,����˵����ȷ����(����)
A���ٺ͢ڲ�����������Ӹ����Ȳ����
B���ٺ͢����ɵ����ʵ����IJ��ת�Ƶ�������ͬ
C��������Na������O2��Ӧ����Na2O�����¶���������Na2O�������ӿ�
D��25 �桢101 kPa�£�Na2O2(s)��2Na(s)===2Na2O(s)����H����317 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ³�ư�4.3ͭ���仯���� ���������븴�ϲ�����ϰ���������棩 ���ͣ�ѡ����
ͭ�����ֳ�����������CuO��Cu2O��ijѧϰС��ȡ0.98 g(�þ�����ƽ����)Cu(OH)2�����壬������ȣ���ͭ�����������ɣ�ʣ������������¶ȱ仯��������ͼ1��ʾ�����⣬ijͬѧ������������ʾͭ���������������������ͭԪ�������Ĺ�ϵ���ߣ���ͼ2��ʾ�������з�����ȷ����(����)��
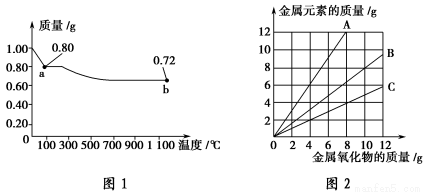
A��ͼ1�в���a��b�Ļ�ѧʽ�ֱ�ΪCu2O��CuO
B��ͼ1���������й�����0.26 g H2O
C��ͼ2���������У���ʾCuO��������CuԪ�������Ĺ�ϵ����������A
D��ͼ2�л��ƴ�������߹�2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com