
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用.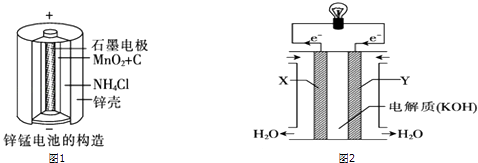
(1)锌锰干电池是应用最普遍的电池之一(如图1所示),锌锰干电池的负极材料是 , 负极发生的电极反应方程式为: . 若反应消耗32.5g 负极材料,则电池中转移电子的数目为 .
(2)目前常用的镍(Ni)镉(Cd)电池其电池总反应式可以表示为:Cd+2NiO(OH)+2H2O ![]() 2Ni(OH)2+Cd(OH)2 , 已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是 . ①以上反应是可逆反应 ②以上反应不是可逆反应
2Ni(OH)2+Cd(OH)2 , 已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是 . ①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
A.①③
B.②④
C.①④
D.②③
(3)图2为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH.则X极为电池的(填“正”或“负”)极,X极的电极反应方程式为
【答案】
(1)锌;Zn﹣2e﹣=Zn2+;NA 或6.02×1023
(2)B
(3)负;CH4+10OH﹣﹣8e﹣=7 H2O+CO ![]()
【解析】解:(1)负极发生氧化反应,锌失电子,电极反应式为:Zn﹣2e﹣=Zn2+ , 32.5g 锌是0.5mol,而1mol的锌失去2mol的电子,所以转移电子的物质的量为1mol,数目为NA 或6.02×1023 , 所以答案是:锌;Zn﹣2e﹣=Zn2+;NA 或6.02×1023;(2)①因为电池冲放电在不同条件下进行,所以该电池反应不是可逆反应,故错误;②因为电池冲放电在不同条件下进行,所以该电池反应不是可逆反应,故正确;③该电池充电时,电能转变为化学能,故错误;④该电池放电时,是将化学能转化为电能,故正确;故选B;(3)电解质溶液为KOH溶液,X电极失去电子,为负极,甲烷被氧化,发生失电子发生氧化反应:CH4﹣8e﹣+10OH﹣═CO ![]() +7H2O,所以答案是:负; CH4+10OH﹣﹣8e﹣=7 H2O+CO
+7H2O,所以答案是:负; CH4+10OH﹣﹣8e﹣=7 H2O+CO ![]() .
.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对于反应2SO2(g)+O2(g)2SO3(g) 最终能增大反应速率的措施是( )
A.降低体系温度
B.增大容器容积
C.减小O2的浓度
D.升高体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤气化和液化是现代能源工业中重点考虑的能源综合利用方案。最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH。
(1)已知:CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1
2CO(g)+O2(g)===2CO2(g) ΔH2
2H2(g)+O2(g)===2H2O(g) ΔH3
则反应CO(g)+2H2(g)===CH3OH(g)的ΔH=______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
②由CO合成甲醇时,CO在250 ℃、300 ℃、350 ℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为________ ℃。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是____________。

③以下有关该反应的说法正确的是________(填序号)。
A.恒温、恒容条件下,若容器内的压强不再发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2 mol CO和6 mol H2充入2 L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为80%
(3)一定温度下,向2 L固定体积的密闭容器中加入1 mol CH3OH(g),发生反应:CH3OH(g) ![]() CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。

0~2 min内的平均反应速率v(CH3OH)=__________。该温度下,反应CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=__________。相同温度下,在一个恒容容器中加入一定量的CO(g)和H2发生:CO(g)+2H2(g)
CH3OH(g)的平衡常数K=__________。相同温度下,在一个恒容容器中加入一定量的CO(g)和H2发生:CO(g)+2H2(g) ![]() CH3OH(g)的反应,某时刻测得体系中各物质的量浓度如下:C(CO)=0.25 mol·L-1,C(H2)=1.0 mol·L-1,C(CH3OH)=0.75 mol·L-1,则此时该反应_____进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
CH3OH(g)的反应,某时刻测得体系中各物质的量浓度如下:C(CO)=0.25 mol·L-1,C(H2)=1.0 mol·L-1,C(CH3OH)=0.75 mol·L-1,则此时该反应_____进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( ) 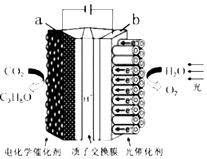
A.a电极的反应为:3CO2+18H++18e﹣=C3H8O+5H2O
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1molO2 , 有44gCO2被还原
D.该装置将化学能转化为光能和电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用两种方法制备氯化物:①金属与氯气直接化合;②金属与盐酸反应。用上述两种方法都可制得的氯化物是
A.CuCl2 B.FeCl2
C.FeCl3 D.AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。下列说法不正确的是

A. 该过程是将太阳能转化为化学能的过程
B. GaN表面发生氧化反应:2H2O-4 e-=== O2↑+4H+
C. Cu表面的反应是:CO2+8e-+6H2O === CH4+8OH
D. H+透过质子交换膜从左向右迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出).图中A试管盛有无水乙醇(沸点为78℃),B处为螺旋状的细铜丝,C处为无水硫酸铜粉末,干燥管D中盛有碱石灰,E为新制的氢氧化铜,F为氧气的发生装置.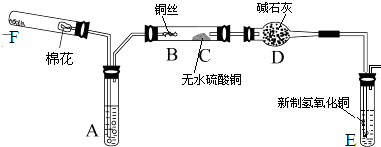
(1)在实验过程中,需要加热的仪器(或区域)有(填仪器或区域的代号A~F) .
(2)B处发生的化学反应方程式为 .
(3)C处应出现的现象是 , D处使用碱石灰的作用是 ,
E处应出现的实验现象是 ,
F处可以添加的固体药品是 .
(4)若本实验中拿去F装置(包括其上附的单孔塞和导管),同时将A试管处原来的双孔塞换成单孔塞用以保证装置的气密性,其它操作不变,则发现C处无明显变化,而E处除了依然有上述(3)中所出现的现象之外,还有气体不断地逸出.由此推断此时B处发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y ![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些补铁剂的成分中含有硫酸亚铁,长期放置会因氧化而变质。检验硫酸亚铁是否变质的试剂是
A. 稀盐酸 B. 石蕊溶液 C. KSCN溶液 D. 氯水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com