
����Ŀ���������� 0.1mol/LNaOH ��Һ 500mL����ͼ��ijͬѧת����Һ��ʾ��ͼ��
(1)ͼ�еĴ�����__________________������ͼ�и����ĵ�������������ƽ�⣬����Ҫ�������У�_____________.
(2)���ݼ����֪������NaOH������Ϊ_______________.
(3)����ʱ������ȷ�IJ���˳���ǣ���ĸ��ʾ��ÿ����ĸֻ����һ�Σ�____________________________.

A���� 30mL ˮϴ���ձ� 2~3 �Σ�ϴ��Һ��ע������ƿ
B��ȷ��ȡ���������������ƹ������ձ��У��ټ�������ˮ��Լ 30mL�����ò���������������ʹ�����ܽ�
C�����ܽ������������Һ�ز�����ע�� 500mL ������ƿ��
D��������ƿ�ǽ��������ߵ�ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ����ǡ����̶�����
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶� 1~2cm ��
(4)�����������������������ҺŨ�Ƚ��к�Ӱ�죨����ƫ��������ƫ����������Ӱ������?
��û��ϴ���ձ� _________________ ��������ˮʱ���������˿̶���________________________ ������ʱ���ӿ̶��� ________________________ .
���𰸡�δ�ò��������� ��ͷ�ι��������� 2.0g BCAFED ƫ�� ƫ�� ƫ��
��������
(1)������ƿ��ת��Һ��ʱӦ�ò������������ʸ�ͼ�Ĵ�����δ�ò�����������(2). ������Һʱ��Ҫ����ƿ���ձ��ͽ�ͷ�ιܡ��������������� (2)������Һ��Ҫ���������ƹ��������Ϊ0.1mol/L��0.5L��40g/mol=2.0g��(3)������Һ��һ��IJ���Ϊ���㣬�������ܽ⣬ת�ƣ�ϴ�ӣ����ݣ�ҡ�ȵȣ�����ʱҪע��Һ����̶���1~2cm ��ʱ���ý�ͷ�ιܼ�ˮʹ��Һ����ǡ����̶����У�����˳��Ϊ BCAFED�� (4)��û��ϴ���ձ�������������ʧ����Һ��Ũ�Ȼ�ƫ�͡�������ˮʱ�����̶��ߣ�����Һ��������Ũ��ƫ�͡�����ʱ���ӿ̶��ߣ�����Һ�������С��Ũ��ƫ�ߡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�������£�0.01 mol/L MOH��Һ��pHΪ10��MOH(aq)��H2SO4(aq)��Ӧ����1 mol���ε���H����24.2 kJ��mol��1��ǿ����ǿ���ϡ��Һ���к���Ϊ��H����57.3 kJ��mol��1����MOH��ˮ��Һ�е������HΪ( )
A. ��69.4 kJ��mol��1 B. ��45.2 kJ��mol��1
C. ��69.4 kJ��mol��1 D. ��45.2 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ����ȷ���ǣ� ��
A.����ϡ���ᷴӦ��2Fe+6H+�T2Fe3++3H2��
B.�������������ᷴӦ��OH��+H+�TH2O
C.п������ͭ��Һ��Ӧ��Zn+Cu2+�TZn2++Cu
D.�Ȼ�����Һ��ϡ���ᷴӦ��Ba2++SO42���TBaSO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ʊ���Ϊ��ҵ�Σ���Ư�ס���Ƶȷ���Ӧ�ù㷺��ʵ��������ͼ��ʾװ���Ʊ��������ơ���ش��������⣺
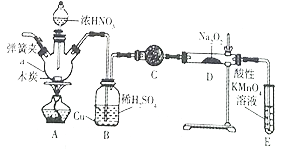
��֪:��3NaNO2+3HCl=3NaCl+HNO3+2NO��+H2O
�����������£�NO��NO2-������MnO4-��Ӧ����NO3-��Mn2+
(1)����a��������_____________��
(2)Bװ���е���Ҫ������_______��C�е��Լ�������____________��
(3)D�з�Ӧ����NaNO2�Ļ�ѧ����ʽΪ_______��Eװ�õ�������______________��
(4)����Dװ��������NaNO2
���� | ���� | ���� |
_____________ | ____________ | ��NaNO2���� |
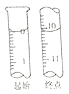
(5) NaNO2�ж������ҹ涨����Ʒ��NaNO2�������ܳ���30mg/kg����1000g��ҹ��������ȡNaNO2�������Һ������0.0050mol/L�����Ը��������Һ�ζ����ζ���ʼ���յ��Һ��λ����ͼ��ʾ�������ҹ������NaNO2�ĺ�����_______mg/kg��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
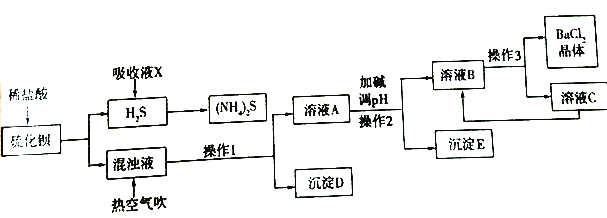
����Ŀ��BaCl2��xH2O����;�㷺�Ļ���������Ʒ���ҹ�Ŀǰ��Ҫ�����������(������Mg2+��Fe3+��)��Ӧ����BaCl2��xH2O��������������ͼ��ʾ��
��֪:����ʱKsp[Mg(OH)2]=1.8��10-11��Ksp[Fe(OH)3]= 4.0��10-38
��ش���������:
(1)д���Ȼ����ĵ���ʽ________�����������Ӧ�Ļ�ѧ����ʽΪ________��
(2)����ҺX��������________��һ����������(NH4)2S��Һ��ͨ��������ɵõ�������ʹ����Һ����������Һ������Ӧ�Ļ�ѧ����ʽΪ________��
(3)����1��������________������3�Ĺ����ǽ���ҺB����Ũ����________�����˵ȡ�
(4)����D�ijɷ���________��
(5)�ȿ�������ʱ���в���HS-ת��ΪS2O32-��ʹ��Ʒ�Դﲻ������Ҫ���ٽ����ữ�����ữ����ʱ�����ӷ���ʽΪ________��
(6)����ʱ�����Ӽ����ҺpH��9������ȫ������������________ ��
(7)�˹���������ѭ�����õ�������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F�Ƕ���������Ԫ��,��ԭ���������������ڶ�������AԪ��ԭ�Ӱ뾶��С��DԪ��ԭ�Ӱ뾶���B�ļ��⻯���ˮ��Һ�ʼ��ԣ�C��Eͬ����,�γɵĻ�����ΪEC2��EC3���ش���������:
��1��E��Ԫ�����ڱ��е�λ��Ϊ_____________________________��
��2���Ƚ�B��C���⻯������ȶ���:_____>��������������(�ѧʽ)
��3��D��C��Ԫ����ɵĻ�����D2C2�ĵ���ʽΪ_____________________��D2C2��ˮ��Ӧ�Ļ�ѧ����ʽΪ ______________________________________________��
��4��������ʵ��˵��Ԫ��F�ķǽ����Ա�Ԫ��E�ķǽ�����ǿ����______��
A��Ԫ��F�γɵĵ��ʱ�Ԫ��E�γɵĵ��ʵ��۵��
B��F��E��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
C��F2ͨ�뵽D2E����Һ�г��ֻ���
D��F�⻯������Ա�E�⻯�������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڹ���Ԫ���������̡�ͭ��п����̫���ܵ�ء����Բ��ϵȿƼ������й㷺��Ӧ�ã��ش��������⣺
��1�����ִ���ѧ�У�������______�ϵ���������������Ԫ�أ���Ϊ��������
��2��д�� Cu2+����Χ�����Ų�ʽ__________���Ƚ������̵ĵ���������(I3)����____��(���������� ��������������)��ԭ����________________��
��3����֪ [Zn(CN)4]2-���ȩ��ˮ��Һ�з�����Ӧ������һ�������� HOCH2CN�����ж���������̼ԭ�ӵ��ӻ���ʽ___________��1mol[Zn(CN)4]2-�е� �� ����Ϊ__________��
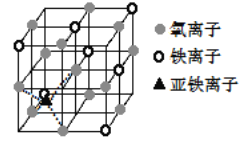
��4����ͼ�Ǿ��� Fe3O4 �ľ������þ�����һ�ִ��Բ��ϣ� �ܵ��硣
�������ж��������Ӵ���������Χ�ɵ�______(��ռ�ṹ)��϶��
�������������ӵĶѻ���ʽ��ij��������ԭ�Ӷѻ���ʽ��ͬ���öѻ���ʽ����Ϊ________��
������ Fe3O4 �����ܵ����ԭ��_________________������������Խ��߳�Ϊ a nm���� Fe3O4 ������ܶ�Ϊ________g��cm��3(�����ӵ������� NA ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�����ӵ����ʵ���Ũ�ȹ�ϵ��ȷ����(�� ��)
A. 0.1 mol/L NaHCO3��Һ��0.1 mol/L NaOH��Һ�������ϣ�������Һ�У�c(Na��)��c(CO![]() )��c(HCO
)��c(HCO![]() )��c(OH��)
)��c(OH��)
B. 0.1 mol/L CH3COOH��Һ��0.1 mol/L NaOH��Һ�������ϣ�������Һ�У�c(OH��)��c(H��)��c(CH3COOH)
C. �����£�pH��2��������pH��12�İ�ˮ�������ϣ�������Һ�У�c(Cl��)��c(H��)��c(NH![]() )��c(OH��)
)��c(OH��)
D. 20 mL 0.1 mol/L CH3COONa��Һ��10 mL 0.1 mol/L HCl��Һ��Ϻ���Һ�����ԣ�������Һ��c(CH3COO��)>c(Cl��)>c(CH3COOH)>c(H��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��ɹ����Ƶ�һ�����Ϳɳ�ŵ� AGDIB ���(��-ʯī˫���ӵ��)����ʯī����﮺Ͻ���Ϊ�缫���ϣ��Գ�����κ�̼�����ܼ�Ϊ���Һ����ط�ӦΪ CxPF6+LiyAl=Cx+LiPF6+Liy-1+Al���ŵ������ͼ������˵����ȷ����
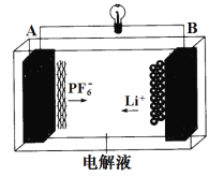
A. BΪ�������ŵ�ʱ��ʧ����
B. ���Һ�����ó�����κ�ˮ����
C. ���ʱ A �缫��ӦʽΪ Cx + PF6- - e-= CxPF6
D. �Ͼ� AGDIB ��ؽ������ŵ紦����ʱ����ת�� 1mol ���ӣ�ʯī�缫�Ͽɻ��� 7gLi
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com