
����Ŀ��A��B��C��D��E��F�Ƕ���������Ԫ��,��ԭ���������������ڶ�������AԪ��ԭ�Ӱ뾶��С��DԪ��ԭ�Ӱ뾶���B�ļ��⻯���ˮ��Һ�ʼ��ԣ�C��Eͬ����,�γɵĻ�����ΪEC2��EC3���ش���������:
��1��E��Ԫ�����ڱ��е�λ��Ϊ_____________________________��
��2���Ƚ�B��C���⻯������ȶ���:_____>��������������(�ѧʽ)
��3��D��C��Ԫ����ɵĻ�����D2C2�ĵ���ʽΪ_____________________��D2C2��ˮ��Ӧ�Ļ�ѧ����ʽΪ ______________________________________________��
��4��������ʵ��˵��Ԫ��F�ķǽ����Ա�Ԫ��E�ķǽ�����ǿ����______��
A��Ԫ��F�γɵĵ��ʱ�Ԫ��E�γɵĵ��ʵ��۵��
B��F��E��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
C��F2ͨ�뵽D2E����Һ�г��ֻ���
D��F�⻯������Ա�E�⻯�������ǿ
���𰸡���3���ڵڢ�A�� H2O>NH3![]() 2Na2O2��2H2O===4NaOH��O2��BC
2Na2O2��2H2O===4NaOH��O2��BC
��������
�ڶ�������AԪ��ԭ�Ӱ뾶��С����A��H��DԪ��ԭ�Ӱ뾶�����D��Na ��B�ļ��⻯���ˮ��Һ�Լ��ԣ���BΪN��C��Eͬ���壬�γɵĻ�����ΪEC2��EC3���ƶ�EΪS��CΪO��F���ڶ�����Ԫ�أ�A��B��C��D��E��Fԭ��������������FΪCl������������A��B��C��D��E��F�ֱ�ΪH��N��O��Na��S��Cl��
��1����ĺ˵����Ϊ16����Ԫ�����ڱ��е�λ��Ϊ��3���ڵڢ�A�壻����������������ǣ���3���ڵڢ�A�塣
��2��B��C���⻯��ֱ�Ϊ��NH3��H2O���ǽ�����Խǿ���⻯��Խ�ȶ������ڷǽ�����O>N������B��C���⻯������ȶ�����H2O>NH3 ���������������������H2O>NH3 ��
��3��D��C��Ԫ����ɵĻ�����D2C2ΪNa2O2����Ϊ���ӻ�����������ʽΪ��![]() ��Na2O2��ˮ��Ӧ�����������ƺ���������ѧ����ʽΪ��2Na2O2��2H2O===4NaOH��O2��������������������ǣ�
��Na2O2��ˮ��Ӧ�����������ƺ���������ѧ����ʽΪ��2Na2O2��2H2O===4NaOH��O2��������������������ǣ�![]() �� 2Na2O2��2H2O===4NaOH��O2����
�� 2Na2O2��2H2O===4NaOH��O2����
��4��A�����ʵ��۷е����������ʣ�������Ϊ�ȽϽ����Ի�ǽ�����ǿ�������ݣ���A������
B���ǽ�����Խǿ���⻯��Խ�ȶ������ClԪ�طǽ�����ǿ��S����B��ȷ��
C������ͨ�뵽Na2S����Һ�г��ֻ��ǣ�S���ʣ���˵��ClԪ�طǽ�����ǿ��S����C��ȷ��
D��Ԫ�صķǽ�����Խǿ,���⻯����ȶ���Խǿ,������������ˮ��������Խǿ,���⻯�������ǿ����,���Բ��ܸ����⻯��ˮ��Һ����ǿ���жϷǽ�����ǿ��,��D������
��������������ѡBC��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������л��������빦�ܹ�ϵͼ���й������������

A. С������ϸ���У�����A�������ǣ�����E�ǵ���
B. ��ͬ������E��F���������ֽ⣬�ͷ������϶����F
C. ����C������Լ��20�֣��������Ԫ����C��H��O��N
D. SARS����������H����ˮ�������CO2��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԷ������ʵĽ����У�����ȷ���ǣ�������
A. �����������Ȼ�̼������������ˮ��������������ԭ������
B. �������ᣨ![]() ���д���һ������̼ԭ�ӣ����¸����ʴ��ڻ�Ϊ��������������칹��
���д���һ������̼ԭ�ӣ����¸����ʴ��ڻ�Ϊ��������������칹��
C. HF���ȶ��Ժ�ǿ������Ϊ����Ӽ����γ����
D. ����ͼ��֪���ԣ�H3PO4��HClO����ΪH3PO4��������1�����ǻ���ԭ��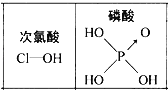
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʮ�Ŵ�ָ��:Ҫ����ʵʩ������Ⱦ�����ж�����Ӯ���챣��ս����ǰ��������������Ҫ��Ŀ����PM2.5�⣬����CO��SO2����������(NO��NO2)��O3�����塣
(1)����β���к���NO��CO���壬�����ô�����CO��NO���д�ת����Ӧ:
2CO(g)+2NO(g) ![]() N2(g)+2CO2(g) ��H
N2(g)+2CO2(g) ��H
����֪�����Ȼ�ѧ����ʽ:
N2(g)+O2(g)=2NO(g) ��H1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g) ��H2=-2210kJ/mol
C(s)+O2(g)=CO2(g) ��H3=-393.5kJ/mol
����H=_________��
����һ���¶���,��2.0molNO��2.4molCO����ͨ�뵽�̶��ݻ�Ϊ2L���ܱ������У���Ӧ�����в������ʵ�Ũ�ȱ仯����ͼ��ʾ����0~15min,��N2��ʾ�ĸ÷�Ӧ��ƽ���ٶ�v(N2)=________�������ַ�Ӧ��ϵ�¶Ȳ��䣬20minʱ�������г���NO��N2��0.4mol����ѧƽ�⽫_____�ƶ�(��������ҡ�����)��

(2)����ͬ�¶��£����������Ϊ1L�ĺ����ܱ������У�����CO��NO��ת����Ӧ���й����ʵ������±�:
������� | ��ʼ���ʵ���/mol | ƽ�����ʵ���/mol | |||
NO | CO | N2 | CO2 | CO2 | |
I | 0.2 | 0.2 | 0 | 0 | a |
II | 0.3 | 0.3 | b | 0.1 | 0.2 |
������I��ƽ��������ѹǿΪ��ʼʱ��0.875������a=________��
������IIƽ��ʱ������ѹǿΪp����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ��ƽ�ⳣ��KΪ________��
(3)����ʹ���Ҵ����Ͳ���������NOx���ŷš�ij�о�С����ʵ�����������Լ�Ag-ZSW-5��CO��NO��ת�������о������NOת��ΪN2��ת�������¶�CO������ı仯�����ͼ��ʾ��

����n(NO)/n(CO)=1�����£�����¶�Ӧ������_______���ҡ�
������ʹ��CO���¶ȳ���775K������NO�ķֽ��ʽ��ͣ�����ܵ�ԭ��Ϊ________��
�ۼ���CO��NOת��ΪN2��ת���������ԭ����_______ (��ƽ���ƶ���ԭ������)��
(4)��NO2��O2������NaNO3��ɵ�ȼ�ϵ��װ������ͼ��ʾ����ʹ�ù�����ʯīI�缫��Ӧ����һ��������Y����õ缫��ӦʽΪ_______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������� 0.1mol/LNaOH ��Һ 500mL����ͼ��ijͬѧת����Һ��ʾ��ͼ��
(1)ͼ�еĴ�����__________________������ͼ�и����ĵ�������������ƽ�⣬����Ҫ�������У�_____________.
(2)���ݼ����֪������NaOH������Ϊ_______________.
(3)����ʱ������ȷ�IJ���˳���ǣ���ĸ��ʾ��ÿ����ĸֻ����һ�Σ�____________________________.

A���� 30mL ˮϴ���ձ� 2~3 �Σ�ϴ��Һ��ע������ƿ
B��ȷ��ȡ���������������ƹ������ձ��У��ټ�������ˮ��Լ 30mL�����ò���������������ʹ�����ܽ�
C�����ܽ������������Һ�ز�����ע�� 500mL ������ƿ��
D��������ƿ�ǽ��������ߵ�ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ����ǡ����̶�����
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶� 1~2cm ��
(4)�����������������������ҺŨ�Ƚ��к�Ӱ�죨����ƫ��������ƫ����������Ӱ������?
��û��ϴ���ձ� _________________ ��������ˮʱ���������˿̶���________________________ ������ʱ���ӿ̶��� ________________________ .
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��X���٣��ͣ���Ϊ���ȷ�Ӧ���Ը÷�Ӧ������˵������ȷ����( )
A.X������һ������M
B.Y������һ������N
C.X��Y��������һ������M��N��������
D.��Ϊ�÷�ӦΪ���ȷ�Ӧ���ʲ��ؼ��ȷ�Ӧ�Ϳ��Է���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������
��1�� ____��
____��
��2�� ____��
____��
��3��![]() ____��
____��
��4���л������� ������Ϊ____��____��
������Ϊ____��____��
��5��2��4����2��ϩд���ṹ��ʽ____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ���������һ��©���Ŀ������ƶ��Ļ�������(����ͼ)���ұ߳���H2��O2����߳���N2����20��ʱ���ұߵĻ�������ȼ����ȴ��ԭ�¶ȡ�������ԭ������������˵ľ���Ϊ�ܳ���1/4����Ӧ�������ֹ�������е�(ˮ��������Բ���)����ԭ��H2��O2������ȿ���Ϊ( )
![]()
A. 2:1 B. 7:2 C. 5:4 D. 8:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A+3B=2C+2D��˵���������ֲ�ͬ����µķ�Ӧ����������
A. �ԣ�A��=0.25 mol/��L��min�� B. �ԣ�B��=0.6 mol/��L��min��
C. �ԣ�C��=0.5 mol/��L��min�� D. �ԣ�D��=0.6 mol/��L��min��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com