
科目:高中化学 来源: 题型:
下列有关铜锌原电池(右图)的叙述正确的是

A.正极反应为Zn-2e-===Zn2+
B.电池反应为Zn+Cu2+===Zn2++Cu
C.在外电路中,电子从正极流向负极
D.取下盐桥,原电池仍可工作
查看答案和解析>>
科目:高中化学 来源: 题型:
对 Fe、Cl2、Al2O3、SiO2、NaClO、NaAlO2的分类正确的是
A.能与碱反应的物质是Cl2、Al2O3、SiO2
B.能与盐酸反应的物质是Fe、Al2O3、SiO2
C.能与水反应的物质是Fe、Cl2、Al2O3
D.具有两性的物质是Al2O3、SiO2、NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸、盐酸、醋酸、钠盐、钾盐、钡盐等两两相互反应,并符合离子方程式:
2H++SO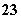 →H2O+SO2↑的化学反应个数有( )
→H2O+SO2↑的化学反应个数有( )
A.4 B.5 C.8 D.12
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。某研究小组设计SnSO4制备路线如下: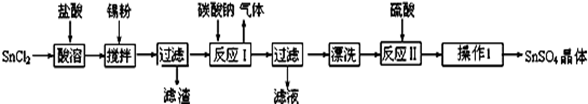
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡)。
请回答下列问题:
(1)锡原子的核电荷数为50,锡元素在周期表中的位置是 第五周期第ⅣA族
(2)SnCl2粉末需加浓盐酸进行溶解,请结合必要的方程式,用平衡移动原理来解释原因
。
(3)加入Sn粉的作用有两个:①调节溶液pH ② 。
(4)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是
。
(5)操作Ⅰ包含的一系列具体实验步骤的名称分别为: 。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断
正确的是
A.含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32-
B.含等物质的量的FeBr2、Fel2的溶液中,缓慢通入氯气:I-、Br-、Fe2+
C.含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3
D.含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
⑴工业上采用电解氧化铝-冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:
2Al2O3  4Al+3O2↑加入冰晶石的作用:_______________________________。
4Al+3O2↑加入冰晶石的作用:_______________________________。
⑵上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为 ,下列可作阴极材料的是________________。
A.铝材 B.石墨 C.铅板 D.纯铝
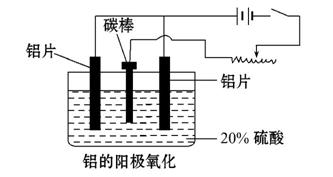
⑶阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为__________________________________。
⑷在铝阳极氧化过程中,需要不断地调整电压,理由是____________ 。
⑸下列说法正确的是 。
A. 阳极氧化是应用原电池原理进行金属材料表面处理的技术
B. 铝的阳极氧化可增强铝表面的绝缘性能
C. 铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D. 铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、N、Q为元素周期表前四周期的六种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X元素在周期表中的位置是 ,属于 区元素,它的外围电子的电子排布图为 。
(2)XZ2分子的立体结构是 ,YZ2分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 。

(3)含有元素N的盐的焰色反应为 色,
许多金属盐都可以发生焰色反应,其原因是
.
(4)元素M与元素Q形成晶体结构如图所示,
设其晶胞边长为a pm,则a位置与b位置之间的距
离为_______pm(只要求列算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com