
硫酸、盐酸、醋酸、钠盐、钾盐、钡盐等两两相互反应,并符合离子方程式:
2H++SO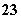 →H2O+SO2↑的化学反应个数有( )
→H2O+SO2↑的化学反应个数有( )
A.4 B.5 C.8 D.12
科目:高中化学 来源: 题型:
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O====7Cu2S+5FeSO4+12H2SO4。下列说法正确的是( )
A.Cu2S既是氧化产物又是还原产物
B.5 mol FeS2发生反应,有10 mol电子转移
C.产物中的SO 有一部分是氧化产物
有一部分是氧化产物
D.FeS2只作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
环境污染问题越来越受到人们的关注,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的。下列环境问题与所对应的物质不相关的是
A.温室效应——二氧化碳
B.光化学污染——二氧化氮
C.酸雨——二氧化碳
D.臭氧层破坏——氟氯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下氯酸钾与浓盐酸反应能放出氯气,现按右下图进行氯气的性质实验。玻璃管内分别装有滴有少量不同溶液的白色棉球,反应—段时间后,对图中指定部位颜色描述正确的是

查看答案和解析>>
科目:高中化学 来源: 题型:
物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,其中气体D、E为单质,试回答:

(1)写出下列物质的化学式:气体B是_____________,H是_______________,
(2)写出A与NaOH溶液反应的离子方程式:______________________________________;
(3)写出反应“I→J”的离子方程式:_____________________________________________;
(4)写出反应“F→G”的离子方程式:____________________________________________;
(5)在溶液I中滴入NaOH溶液,可观察到的现象是:_______________________________;
其反应的原理是(化学方程式)_________________________________________________.
(6)检验溶液J中的金属阳离子,用______________________试剂(填化学式),其现象是
_________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是重要的金属元素,用途极广。
(1)高铁酸钾(K2FeO4)具有很强的氧化性,常用作净水剂,对环境无不良影响,被人们称为“绿色化学”试剂。工业上,可用铁作阳极,电解KOH溶液制备K2FeO4,其阳极的电极反应式为___________________。
(2)某高效净水剂可由Fe(OH)SO4聚合得到。工业上以FeSO4、NaNO2和稀硫酸为原料来制备Fe(OH)SO4,反应中有NO生成,化学方程式为 。
(3)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ/mol
②C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ/mol
高炉炼铁过程中发生的主要反应为:
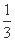 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g) 
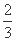 Fe(s)+CO2(g) ΔH = a kJ/mol,则a = kJ/mol。
Fe(s)+CO2(g) ΔH = a kJ/mol,则a = kJ/mol。
已知该反应在不同温度下的平衡常数如下表:
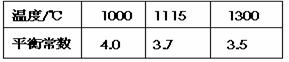
在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,此时v正 v逆(填“等于”、“大于”或“小于”)。经过l0 min,在1000℃达到平衡,则该时间范围内反应的平均反应速率v (CO2)= 。欲提高上述反应中CO的平衡转化率,可采取的措施是 ;
A.提高反应温度 B.移出部分CO2 C.加入合适的催化剂 D.减小容器的容积
(4)一定温度下的难溶电解质在水溶液中达到溶解平衡时。已知下表数据,对含等物质的量的CuSO4、FeSO4、Fe2(SO4) 3的混合溶液的说法,不科学的是
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的PH值 | ≥9.6 | ≥6.4 | 3~4 |
A. 向该溶液中加少量铁粉不能观察到红色固体析出
B. 该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
C. 向该溶液中加入适量氯水,并调节pH值到3~4后过滤,可得到纯净的CuSO4溶液
D. 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓) Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:


(1)这些装置的连接顺序(按气体左右的方向)是 → → → →
→ (填各接口的编号)。
(2)实验时甲仪器中橡皮管的作用是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)装置Ⅳ的作用是 。
(5)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com