
【题目】实验室利用下图装置制取无水A1C13(183℃升华,遇潮湿空气即产生大量白雾),下列说法正确的是
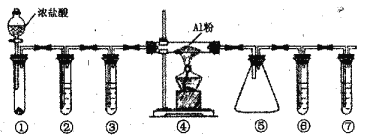
A. ①的试管中盛装二氧化锰,用于常温下制备氯气
B. ②、③、⑥、⑦的试管中依次盛装浓H2SO4、饱和食盐水、浓H2SO4、NaOH溶液
C. 滴加浓盐酸的同时点燃④的酒精灯
D. ⑤用于收集AlCl3,⑥、⑦可以用一个装有碱石灰的干燥管代替
【答案】D
【解析】
由实验装置可知,①为浓盐酸与强氧化剂反应生成氯气,②中饱和食盐水可除去氯气中的HCl,③中浓硫酸干燥氯气,④中Al与氯气反应生成AlCl3,⑤为收集氯化铝的装置;⑥中浓硫酸防止水进入④和⑤中引起氯化铝水解,⑦中NaOH溶液吸收尾气中的氯气,以此来来解答。
A. ①的试管中盛装二氧化锰,常温与浓盐酸不反应,需要加热制备氯气,A项错误;
B. 由上述分析可知②、③、⑥、⑦的试管中依次盛装饱和食盐水、浓H2SO4、浓H2SO4、NaOH溶液,B项错误;
C. 滴加浓盐酸使产生的氯气排出装置中的氧气,再点燃④的酒精灯,C项错误;
D. ⑤用于收集AlCl3,⑥、⑦两个装置要防止其水解,且要吸收尾气中的氯气,则⑥、⑦可以用一个装有碱石灰的干燥管代替,D项正确;
答案选D。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、M是原子序数依次增大五种元素,基态X原子的s电子数比p电子数多3个,在周期表中Y与Z相邻且第一电离能Y>Z,Z、R同主族,M核外电子有29种运动状态,请回答下列问题:
(1)基态M2+的电子排布式为__________,X、Y、Z、M的电负性由大到小的顺序为__________。
(2)化合物XCl3的中心原子杂化类型为__________;YCl3的立体构型为__________,XCl3、YCl3分子中属于非极性分子的是__________。
(3)H2Z、H2Z2、H2R的沸点分别为100℃、158℃,-60.4℃,试解释此种现象____________。
(4)H2RO3的K1和K2分别为1.54×10-2和1.02×10-7,熔融化状态下RO3不能导电而Na2O能导电,请根据结构与性质的关系解释下列问题:
①K1>K2:____________。
②RO3不能导电而Na2O能导电:____________。
(5)Z、M形成的一种化合物晶胞如图所示: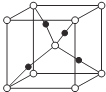 (实心球代表M)
(实心球代表M)
①该化合物的化学式为_______________。
②若晶胞参数为apm。列式计算该晶胞的密度籽=____g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)![]() CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g)![]() CO2(g)+2H2(g) △H=Q2kJ·mol-1
CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为____。
(2)工业上可用CO和H2O (g) 来合成CO2和H2,再利用(1)中反应原理合成甲醇。某温度下,将1molCO和1.5molH2O充入10L固定密闭容器中进行化学反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
①0~10min内H2O(g)的平均反应速率为_________________。
②若想加快正反应速率的同时提高CO的转化率,可以采用的方法是__________。
a.升高温度 b.缩小容器的体积
c.增大H2O (g)的浓度 d.加入适当的催化剂
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),重新达到化学平衡状态时,此时平衡混合气体中H2的体积分数为_____。
(3)甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为0.1 mol/L CuSO4溶液 (假设反应前后溶液体积不变) ,当向甲池通入气体a和b时,D极附近呈红色。回答下列问题:
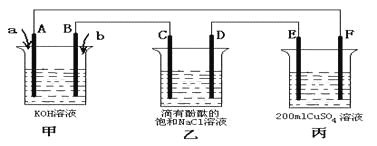
①a物质是__________, A电极的电极反应式为__________。
②乙装置中的总化学反应方程式为___________________。
③当乙装置中C电极收集到224mL(标况下)气体时, 丙中溶液的pH=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化铝和氢氧化铝的叙述错误的是( )
A. Al(OH)3受热能分解
B. Al2O3既能溶于强酸溶液又能溶于强碱溶液
C. Al(OH)3胶体能吸附水中的悬浮物
D. Al(OH)3与过量的浓氨水反应生成NH4[Al(OH)4]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。下表列出了一些化学键的键能E:
化学键 | H—H | Cl—Cl | O===O | C—Cl | C—H | O—H | H—Cl |
E/kJ·mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
请回答下列问题:
如图表示某反应的能量变化关系,则此反应为________(填“吸热”或“放热”)反应,其中ΔH=______________(用含有a、b的关系式表示)。

若图示中表示反应 H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则b=________kJ·mol-1,x=__________。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃利用空气中的氧气跟氯化氢反应制氯气。反应的化学方程式为___________________________________。若忽略温度和压强对反应热的影响,根据上题中的有关数据,计算当反应中有1 mol电子转移时,反应的能量变化为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼![]() 最重要的用途是作为铁合金的添加剂,用CO还原
最重要的用途是作为铁合金的添加剂,用CO还原![]() 制备单质Mo的装置如图所示
制备单质Mo的装置如图所示![]() 尾气处理装置已省略
尾气处理装置已省略![]() 下列说法正确的是
下列说法正确的是![]()
![]()
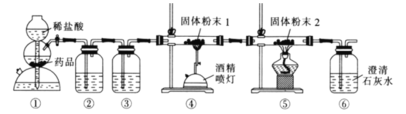
A.装置![]() 中的药品为石灰石粉末
中的药品为石灰石粉末
B.装置![]() 中盛有饱和碳酸氢钠溶液,
中盛有饱和碳酸氢钠溶液,![]() 中盛有澄清石灰水
中盛有澄清石灰水
C.在装置![]() 中生成了钼单质
中生成了钼单质
D.![]() 中溶液变浑浊,说明产生的
中溶液变浑浊,说明产生的![]() 一定是来自
一定是来自![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到实验目的的是
选项 | 实验方案 | 实验目的 |
A. | 向酸性 | 验证草酸具有还原性 |
B. | 向相同浓度的NaBr和KI溶液中分别滴加足量氯水,观察溶液颜色变化 | 比较溴元素和碘元素的非金属性强弱 |
C. | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
D. | 将 | 制备硫酸镁晶体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
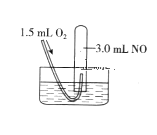
【题目】如图所示,室温下向盛有3.0mL NO的试管中缓缓通入1.5mL O2(所有气体的体积均在标准状况下测定)。
试回答下列问题:
(1)写出观察到的现象(可不写满,也可补充):
①__________;
②__________;
③__________。
(2)上述过程中发生反应的化学方程式有__________。
(3)最终试管中剩余的气体是__________,体积为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我国成功研制出高效电催化固氮催化剂Mo2N,如图所示,在0.1mol·L-1盐酸溶液中,在一定电压下具有较高的产氨速率和稳定的电流效率。下列判断错误的是
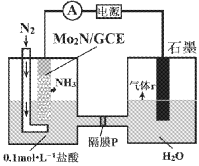
A. 石墨电极为阳极
B. P为阳离子交换膜
C. Mo2N/GCE电极区反应式为N2+6H++6e-=2NH3
D. 为提高溶液的导电性,可在石墨电极区加入适量的盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com