
����Ŀ��(1)����32 gij���壬Ħ������Ϊ16 g��mol-1����
�ٸ�����Ϊ___________ mol��
�ڸ���������������Ϊ___________ NA��
�۸������ڱ�״���µ����Ϊ_________ L��
(2) _________g H2O�е���ԭ����Ŀ���״����4.48 L CO2�е���ԭ����Ŀ��ͬ��
(3)ͬ��ͬѹ�£�ͬ����İ���(NH3)����������������______����ͬ�����İ������������������_________��
(4)ijԪ��1��ԭ�ӵ�����Ϊa g��1 �� 12Cԭ������Ϊb g�����Ԫ�ص�����ԭ�ӵ����ԭ��������ֵ��_________��_______��
���𰸡�2244.87.217��3232��1712a/b a��NA
��������
(1)����n=m/M=V/Vm=N/N A ���㡣
(2)����n=V/Vm,���������̼�����ʵ��������Oԭ����Ŀ��ȼ���ˮ�����ʵ������ٸ���m=nM����ˮ����������
(3)ͬ��ͬѹ�£�ͬ��������壬����֮�ȵ���Ħ������֮�ȣ�ͬ��ͬѹ�£�ͬ��������������֮����Ħ�������ɷ��ȣ�
��4����һ��12Cԭ��������1/12Ϊ��������ԭ�ӵ�����������Ƚ����õ��ıȣ�Ϊ����ԭ�ӵ����ԭ��������Ħ����������g��mol��1����λ����ֵ�ϵ��ڸ����ʵ���Է������������ԭ��������
(1)����32 gij���壬Ħ������Ϊ16 g��mol-1����
�ٸ�����Ϊn=m/M=32g/16g��mol��1=2mol����
�ڸ���������������Ϊn��NA=2mol��NA=2NA��
�۸������ڱ�״���µ����Ϊn��22.4L��mol��1=2mol��22.4L��mol��1=44.8 L��
(2)��״����4.48 LCO2�����ʵ���Ϊ4.48 L/22.4L��mol��1=0.2mol����֮������ԭ����Ŀ��ͬ��ˮ������Ϊ0.2mol��18g��mol��1��2/1=7.2g��
(3)ͬ��ͬѹ�£�ͬ��������壬����֮�ȵ���Ħ������֮�ȣ���ͬ��ͬѹ�£�ͬ����İ�����NH3����������������Ϊ17g��mol��1��32g��mol��1=17��32��
ͬ��ͬѹ�£�ͬ��������������֮����Ħ�������ɷ��ȣ���ͬ��ͬѹ�£���ͬ�����İ����������������Ϊ32g��mol��1��17g��mol��1=32��17��
(4)һ��12C��������bg��ijԪ��1��ԭ�ӵ�������ag�����ԭ�ӵ����ԭ������=![]() ��
��
1molijԪ��ԭ�ӵ�����ΪaNAg��ԭ�ӵ�Ħ�������������ԭ��������ֵ��ȣ�R�����ԭ������ΪaNA��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ˮ�����ӻ���25��ʱKw=1��10��14��100��ʱKw=1��10��12���Իش��������⣮
��1��25��ʱ��ijNa2SO4��Һ��c��SO42����=5��10��4 molL��1��ȡ����Һ1mL��ˮϡ����10mL����ϡ�ͺ���Һ��c��Na+����c��OH����=_________��
��2����100��ʱ�����ij��ҺpH=7������Һ��_________�����������������������������ԣ�
��3����100���¶���pH=11��NaOH��Һa L��pH=1��H2SO4��Һb L��ϣ������û��ҺpH=2����a��b=________��
��4��ij�¶�ʱ����pH��2��ϡ�����pH��11��NaOH��Һ�������Ϻ���Һ�����ԣ�����¶���ˮ�����ӻ�����Kw��________��
�ٸ��¶���( T ��)����100 mL 0.1 mol��L��1��ϡH2SO4��Һ��100 mL 0.4 mol��L��1��NaOH��Һ��Ϻ�(��Һ����仯���Բ���)����Һ��pH��____________��
�ڸ��¶���(T ��)��1�����ϡ�����10�����NaOH��Һ��Ϻ���Һ�����ԣ���ϡ�����pH(pHa)��NaOH��Һ��pH(pHb)�Ĺ�ϵ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ŷŵķ�Һ�к��д�����K+��Cl-��Br-������������Ca2+��Mg2+��SO42-��ij�о���С���������ַ�Һ����ȡ�ϴ������Ȼ��ؾ��弰Һ�壬������������µ�����(��ʾ��ͼ���Լ�a�������ǽ�Br-ת��ΪBr2)
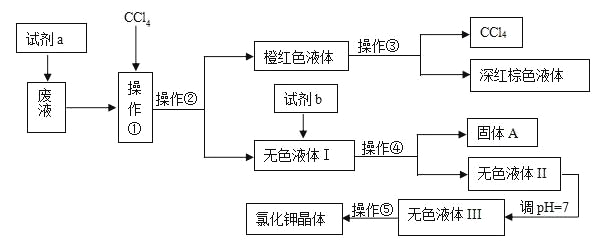
�Լ�b��Ҫ�������Լ���ѡ����Na2CO3��Һ������K2CO3��Һ��KOH��Һ��BaCl2��Һ��Ba(NO3)2��Һ��ϡ����
��1�������٢ڢۢܢݵ�������________(�����)��
A. ��ȡ�����ˡ���Һ�����ˡ������ᾧ
B. ��ȡ����Һ�������ˡ������ᾧ
C. ��Һ����ȡ�����ˡ����ˡ������ᾧ
D. ��ȡ����Һ����Һ�����ˡ������ᾧ
��2����ȥ��ɫҺ����е�Ca2+��Mg2+��SO42-��ѡ���Լ�b(�Լ�b����һ���Լ�)���������Լ������μ�˳��������_____________________________________________________________��
��3������pH=7��������________________________________________�����õ��Լ���___________(������)
��4�����������õ��Ĵ�������������________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ���������ʵ���Ũ�ȹ�ϵ��ȷ����(����)
A. Ũ�Ⱦ�Ϊ0.1 mol��L��1�İ�ˮ������������Ϻ�c(H��)��c(OH��)��c(NH3��H2O)
B. ��Ũ�ȵ�̼���ơ�̼��������Һ��Ϻ�c(CO![]() )��c(HCO
)��c(HCO![]() )
)
C. ��NaHB��Һ��һ���У�c(Na��)��c(HB��)��2c(B2��)
D. Na2CO3��Һ�У�2c(Na��)��c(CO![]() )��c(HCO
)��c(HCO![]() )��c(H2CO3)
)��c(H2CO3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪ��������У�����ͭ��������ᣨHN3�����ɵ�ԭ��أ��ܷ�Ӧ����ʽΪ�� 2Cu+2Cl- +HN3+3H+��2CuCl(s)+N2��+NH4+�����������������
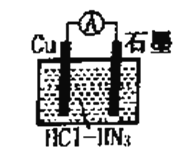
A. ���ӵ�����ΪCu��![]() ��ʯī
��ʯī
B. �����ĵ缫��ӦʽΪCu+Cl�D�De����CuCl(s)
C. ��Ӧһ��ʱ�����������Һ��pH��С
D. ��״���£�����224mL N2ʱ��ͭת�Ƶĵ�����Ϊ0.02NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʼ��仯�������Ź㷺Ӧ�á�
��1����1.0 L�ܱ������з���0.10mol PCl5(g)��һ���¶Ƚ������·�Ӧ:PCl5(g)![]() PCl3(g)��Cl2(g) ��H1
PCl3(g)��Cl2(g) ��H1
��Ӧʱ��(t)��������������ѹǿ(p/100kPa)�����ݼ��±���
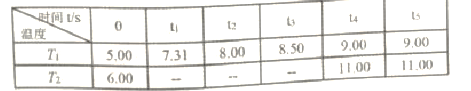
�ش���������:
��PCl3�ĵ���ʽΪ_______��
��T1�¶��£���Ӧƽ�ⳣ��K=______��
��T1___T2�����������������������ͬ����PCl5��ƽ��ת���ʦ�1(T1) __��2(T2)��
��2��PCl5��PCl3��ת��ΪH3PO4��H3PO3����֪�����Ȼ�ѧ����ʽ��
PCl5(g)��4H2O(l) = H3PO4(aq)��5HCl(aq) ��H2
PCl3(g)��3H2O(l) = H3PO3(aq)��3HCl(aq) ��H3
H3PO3(aq)��Cl2(g)��H2O(l) = H3PO4(aq)��2HCl(aq) ��H4
��H4= ______�����æ�H1����H2����H3��ʾ��
��3����������[Co(H2PO2)2]�㷺���ڻ�ѧ���ܣ��Խ����ܺʹ�������Ϊԭ�ϣ��������ҵ������۵�ⷨ�Ʊ���ԭ������ͼ��
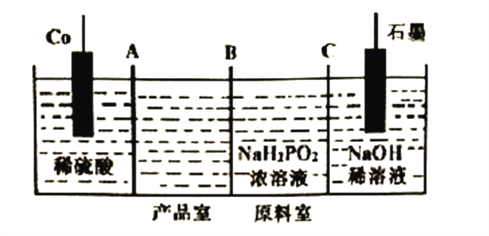
��Co�ĵ缫��ӦʽΪ______________��A��B��CΪ���ӽ���Ĥ������BΪ__________���ӽ���Ĥ�����������������
�ڴ�����(H3PO2)ΪһԪ���ᣬ����������Һ������Ũ���ɴ�С��˳����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ����ˮ�ĵ������ƣ����������ĵ��룺2NH3![]()
![]() ��
��![]() ���Ը���ϵ��˵���д������
���Ը���ϵ��˵���д������
A. Һ���к���NH3��![]() ��
��![]() ����
����
B. һ���¶��£�Һ����c(![]() )��c(
)��c(![]() )�ij˻�Ϊһ����
)�ij˻�Ϊһ����
C. Һ���ĵ���ﵽƽ��ʱ��c(NH3)��c(![]() )��c(
)��c(![]() )
)
D. ֻҪ�������������ʣ�Һ����c(![]() )������c(
)������c(![]() )���
)���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Һ�еĻ�ѧ��Ӧ��������ӷ�Ӧ������Ҫ��ش��������⣺
��1���μ��(���϶�Na2CO3��NaCl)������ֲ�����������û�ѧ����ʽ��ʾ��
�μ�ز������Ե�ԭ��__________________________________________��
��2����֪ˮ��������ƽ�⣺H2O��H2O![]() H3O����OH������ˮ�м���NaHSO4���壬ˮ�ĵ���ƽ����________�ƶ�����������Һ��________�ԡ�
H3O����OH������ˮ�м���NaHSO4���壬ˮ�ĵ���ƽ����________�ƶ�����������Һ��________�ԡ�
��3����ȡpH���������ȵ�NaOH��Һ�Ͱ�ˮ�ֱ���ˮϡ��m����n����ϡ�ͺ�pH����ȣ���m________(����������������������)n��
��4�������£���pH��6��CH3COOH��CH3COONa�Ļ����Һ��ˮ���������c(OH��)��________��
��5����֪�������£������NH3��H2O�ĵ���ƽ�ⳣ����Ϊ1.74��10��5���� NH4HCO3��Һ��________�ԣ�NH4HCO3��Һ�����ʵ���Ũ������������________(�ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1.15 g�����Ƹ�ˮ��Ӧ�õ�100 mL��Һ���Լ��㣺
���ɵ������ڱ�״�����Ƕ��ٺ�����
_________________
��Ӧ��������Һ�����ʵ���Ũ���Ƕ��٣�
_________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com