
| Β―ι¥Έ ΐ±ύΚ≈ | ¥ΐ≤β“ΚΧεΜΐmL | ΒΈ»κΒΡ±ξΉΦ“ΚΧεΜΐΘ®mLΘ© |
| 1 | 25.00 | 28.95 |
| 2 | 25.00 | 25.05 |
| 3 | 25.00 | 24.95 |



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΦΤΥψΧβ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΒΞ―ΓΧβ
| AΘ°c(NH4ΘΪ)+ c(HΘΪ) ΘΫc(OHΘ≠) |
| BΘ°c(NaΘΪ)ΘΫc(ClΘ≠)ΘΨc(HΘΪ)=c(OHΘ≠) |
| CΘ°c(NH4ΘΪ)+c(NH3ΓΛH2O) =2c(ClΘ≠) |
| DΘ°c(NH4ΘΪ) ΘΨc(NH3ΓΛH2O)ΘΨc(OHΘ≠)ΘΨc(HΘΪ) |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΒΞ―ΓΧβ
| AΘ°5.0 | BΘ°4.2 | CΘ°4.0 | DΘ°3.2 |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚ Β―ιΧβ
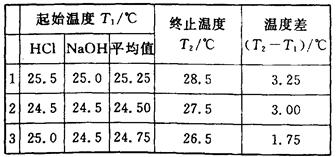
| AΘ°»ή“ΚΜλΚœΚσΈ¥ΦΑ ±Η«ΚΟΝΩ»»ΦΤ±≠Η« |
| BΘ°«ψΒΙ»ή“ΚΧΪΩλΘ§”–…ΌΝΩΫΠ≥ω…’±≠ |
| CΘ°»ή“ΚΜλΚœΚσΫΝΑη≤ΜΙΜ |
| DΘ°Έ¥Β»Έ¬Ε»…ΐΒΫΉνΗΏ÷ΒΨΆΦ«¬ΦΈ¬Ε»ΦΤ Ψ ΐ |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΧνΩ’Χβ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΒΞ―ΓΧβ
AΘ°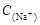 =2[ =2[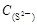 + +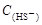 + +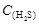 ] ] |
BΘ°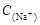 + +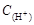 = =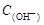 + +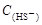 + +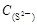 |
CΘ°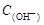 = =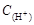 + +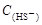 +2 +2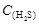 |
DΘ°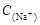 > >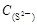 > >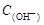 > >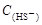 |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΒΞ―ΓΧβ
| AΘ°1010ΘΚ1 | BΘ°5ΓΝ109ΘΚ1 | CΘ°108ΘΚ1 | DΘ°1ΘΚ1 |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΒΞ―ΓΧβ
| AΘ°0.05 molΓΛLΘ≠1ΒΡH2SO4»ή“ΚΘ§pHΘΫ1 |
| BΘ°0.001 molΓΛLΘ≠1ΒΡNaOH»ή“ΚΘ§pHΘΫ11 |
| CΘ°0.005 molΓΛLΘ≠1ΒΡH2SO4»ή“Κ”κ0.01 molΓΛLΘ≠1ΒΡNaOH»ή“ΚΒ»ΧεΜΐΜλΚœΘ§ΜλΚœ»ή“ΚΒΡpHΈΣ6Θ§»ή“Κœ‘Υα–‘ |
| DΘ°Άξ»Ϊ÷–ΚΆpHΘΫ3ΒΡH2SO4»ή“Κ50 mLΘ§–η“ΣpHΘΫ11ΒΡNaOH»ή“Κ50 mL |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com