
����Ŀ������Ҫ��д����Ӧ�Ļ�ѧ����ʽ��
��1���ױ���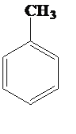 ���ڹ��������º���������һȡ����Ӧ�Ļ�ѧ����ʽ��_______________
���ڹ��������º���������һȡ����Ӧ�Ļ�ѧ����ʽ��_______________
��2���Լױ�Ϊԭ���Ʊ����ȼױ���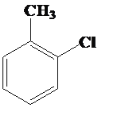 ���Ļ�ѧ����ʽ��__________
���Ļ�ѧ����ʽ��__________
��3���Ա�ϩ��![]() ��Ϊԭ�Ͽ��Ժϳɸ��ͣ���������
��Ϊԭ�Ͽ��Ժϳɸ��ͣ���������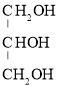 ������ϳɲ������£�
������ϳɲ������£�
![]() ___________
___________![]() 1,2,3-���ȱ���
1,2,3-���ȱ���![]() ������
������
��֪��![]()
��д����������Ӧ�Ļ�ѧ����ʽ��___________________
��4�����мױ��ͱ������Ļ����������H����Ϊa%����![]() ___________��С�������1λ��
___________��С�������1λ��
���𰸡� +Cl2
+Cl2![]()
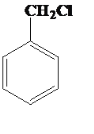 +HCl
+HCl  +Cl2
+Cl2![]()
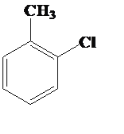 +HCl CH2=CHCH2Cl+Cl2��CH2ClCHClCH2Cl 8.7
+HCl CH2=CHCH2Cl+Cl2��CH2ClCHClCH2Cl 8.7
��������
��1���ױ���Cl2�ڹ��������·���ȡ����Ӧ����Ӧ����ʽΪ +Cl2
+Cl2![]()
 +HCl��
+HCl��
��2��Cl2����FeCl3�Ĵ�����ױ�������λ���߶�λ��ȡ����Ӧ�����üױ���ȡ���ȼױ��ķ���ʽΪ +Cl2
+Cl2![]()
 +HCl��
+HCl��
��3���Ա�ϩΪԭ�Ϻϳɱ����������ȱ�ϩͨ����֪��Ӧ����CH2=CHCH2Cl��CH2=CHCH2Cl��ͨ����Cl2�ļӳɷ�Ӧ�õ�CH2ClCHClCH2Cl����ͨ��±������ˮ�ⷴӦ�õ����������ϳɹ����еڶ����Ļ�ѧ����ʽΪCH2=CHCH2Cl+Cl2��CH2ClCHClCH2Cl��
��4���ױ��ͱ�������Ħ��������ͬ����Hԭ�Ӹ�����ͬ���ʶ�����ʲô������ϣ��������Hԭ�ӵ����������㲻�䣬H����������Ϊ![]() =8.7%��
=8.7%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���3molA�����1molB�������ڹ̶��ݻ�Ϊ2L���ܱ������У�������Ӧ��3A(g)+B(g)C(g)+2D(g)��2minĩ�÷�Ӧ�ﵽƽ�⣬����D�����ʵ�����ʱ��ı仯�����ͼ��ʾ�������ж���ȷ����( )
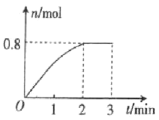
A.�����������ܶȲ��ٸı�ʱ���÷�Ӧ��һ���ﵽƽ��״̬
B.2min��ѹ��ʹ����Ӧ���ʼӿ죬�淴Ӧ���ʱ���
C.��2min��3min�����У�������ռ��ѹǿ����仯
D.��Ӧ������A��B��ת����֮��Ϊ3:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ף�P4S3���ǻ���ɫ��״���壬��ȼ���ж������ӽṹ֮һ��ͼ��ʾ����֪��ȼ��ʱP������ΪP4010�������й�P4S3��˵���в���ȷ����

A. P4S3����Ԫ��Ϊ+3��
B. P4S3���ڹ��ۻ�����
C. P4S3���ȼ�յĻ�ѧ����ʽΪP4S3+8O2=P4O10+3SO2
D. 1mol P4S3�����к���9mol���ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڱ���������ȷ����(����)

A. ��Ӧ��Ϊȡ����Ӧ����Ӧ���ڹ��������½���
B. ��Ӧ��Ϊ������Ӧ����Ӧ�����ǻ�������������Ũ��
C. ��Ӧ��Ϊȡ����Ӧ���л�������һ����
D. ��Ӧ����1 mol�������3 mol H2�����ӳɷ�Ӧ������Ϊһ�������Ӻ�������̼̼˫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС�����ʵ�����ȼ�յIJ��P�����ʽ�����֤��ʵ��װ������ͼ��ʾ��
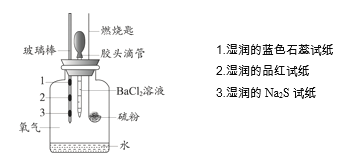
����ʵ����ʵ�����ý����������
ʵ����ʵ | ���ý��� | |
A | ʪ���Ʒ����ֽ��ɫ | ֤����ȼ�յIJ�������SO2 |
B | ʪ���Na2S��ֽ�ϳ��ֵ���ɫ���� | ֤�����ȼ�ղ����ܱ���ԭ���� |
C | ʪ�����ɫʯ����ֽ��� | ֤�����ȼ�ղ��������������� |
D | ����BaCl2��Һ������ɫ���� | ֤����ȼ�յIJ�������SO3 |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ����Ȼ���еĵ�ˮ�������������������ˡ������ȹ��մ�����õ��ġ����õ�����ˮ�������ж������ȣ�ClO2��������أ�K2FeO4���ȡ�
��1��ij�о�С������ͼװ���Ʊ�����ClO2���г�װ������ȥ����

���ϣ�ClO2������Ϊ������ˮ������ˮ��Ӧ�����壬ˮ��Һ�������ɫ��11��ʱҺ���ɺ���ɫҺ�塣��NaClO3��HCl���Ҵ���ҺΪԭ���Ʊ�ClO2�ķ�ӦΪ2NaClO3 + 4HCl= 2ClO2��+ Cl2��+ 2NaCl + 2H2O��
�ٱ�ˮԡ��������____________��
�� NaOH��Һ�з�������Ҫ��Ӧ�����ӷ���ʽΪ________________��
��2����ClO2ˮ��Һ�μӵ�KI��Һ�У���Һ���ػƣ��������м�������CCl4�������ã��۲쵽____��֤��ClO2���������ԡ�
��3��ClO2��ɱ�����������л�����������������Σ�ClO2-�����轫��ת��ΪCl-��ȥ�������Լ��У��ɽ�ClO2-ת��ΪCl-����_____________________������ĸ��ţ���
a. FeSO4 b. O3 c. KMnO4 d. SO2
��4��K2FeO4��һ�����͡���ɫ�Ķ�ܾ�ˮ�������������������������������������������ɫ������������Ϊһ�塣ʵ�����Ʊ�K2FeO4�ķ������£��ڱ�ˮԡ�У���KClO��KOH�Ļ����Һ��������μ����������������Ͻ��衣
�������Ʊ�K2FeO4��Ӧ�����ӷ���ʽΪ______________________��
�ھ�ˮ�����У�K2FeO4���������������õ�ԭ����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ӿ���ռ�ṹʾ��ͼ����Ϊ�����ӣ���Ϊ�����ӣ���M���������ӣ�N���������ӣ���ѧʽΪMN2�ľ���ṹΪ

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ�������
A. �����£�0.2 mol Fe������ˮ������Ӧ�����ɵ�H2������ĿΪ0.3NA
B. �����£�1 L pH=13��NaOH��Һ�У���ˮ�����OH��������ĿΪ0.1NA
C. ����ȼ�ϵ����������22.4 L����״��������ʱ����·��ͨ���ĵ�����ĿΪ2NA
D. 5NH4NO3![]() 2HNO3+4N2��+9H2O��Ӧ�У�����28 g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
2HNO3+4N2��+9H2O��Ӧ�У�����28 g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��µ�ˮ��Һ�У�c��H+����10��xmol/L��c��OH������10��y mol/L��x��y�Ĺ�ϵ��ͼ��ʾ��
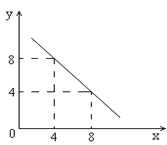
��1�����¶���ˮ�����ӻ�Ϊ__________�����¶�_____________���£�����ڡ��������ڡ����ڡ�����
��2�����¶���0.01 mol/L NaOH��Һ��pHΪ_____��
��3��������pH�⣬��ѧ�һ���������ȣ�AG������ʾ��Һ������ԣ�![]() ������¶��£�0.01mol/L��������AG��_________��
������¶��£�0.01mol/L��������AG��_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com