
【题目】自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。常用的自来水消毒剂有二氧化氯(ClO2)和高铁酸钾(K2FeO4)等。
(1)某研究小组用下图装置制备少量ClO2(夹持装置已略去)。

资料:ClO2常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以NaClO3和HCl的乙醇溶液为原料制备ClO2的反应为2NaClO3 + 4HCl= 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O。
①冰水浴的作用是____________。
② NaOH溶液中发生的主要反应的离子方程式为________________。
(2)将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量CCl4,振荡、静置,观察到____,证明ClO2具有氧化性。
(3)ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO2-),需将其转化为Cl-除去。下列试剂中,可将ClO2-转化为Cl-的是_____________________(填字母序号)。
a. FeSO4 b. O3 c. KMnO4 d. SO2
(4)K2FeO4是一种新型、绿色的多功能净水剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等性能为一体。实验室制备K2FeO4的方法如下:在冰水浴中,向KClO和KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌。
①上述制备K2FeO4反应的离子方程式为______________________。
②净水过程中,K2FeO4起到吸附、絮凝作用的原理是____________。
【答案】分离Cl2和ClO2 Cl2+2OH-=Cl-+ClO-+H2O 溶液分层,下层为紫色 ad 3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O 净水过程中,FeO42-发挥氧化作用,被还原成Fe3+,Fe3+水解生成Fe(OH)3胶体,起到吸附、絮凝作用
【解析】
(1)①根据反应2NaClO3 + 4HCl= 2ClO2↑+ Cl2↑+2NaCl+2H2O 可知,制备ClO2的同时生成氯气,利用ClO2 11℃时液化成红棕色液体,可用冰水浴将Cl2和ClO2分离,获得纯净的ClO2,
答案为:分离Cl2和ClO2;
② NaOH溶液为尾气处理装置,作用是吸收产生的氯气,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
答案为:Cl2+2OH-=Cl-+ClO-+H2O
(2)向混合后的溶液中加入适量CCl4,振荡、静置,CCl4密度比水大,且不溶于水,若观察到溶液分层,且下层为紫色,说明溶液中生成碘单质,进一步说明将ClO2水溶液滴加到KI溶液中发生反应,碘离子由-1价变为0价,化合价升高被氧化,则证明ClO2具有氧化性。
答案为:溶液分层,下层为紫色;
(3)需将ClO2-其转化为Cl-除去,氯元素的化合价从+3价变为-1价,化合价降低得电子,被还原,需要加入还原剂,
a. FeSO4中亚铁离子具有还原性,可以做还原剂,故a符合;
b. O3具有强氧化性,故b不符合;
c. KMnO4具有强氧化性,故c不符合;
d. SO2具有还原性,可以做还原剂,故d符合;
答案为ad;
(4)K2FeO4是一种新型、绿色的多功能净水剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等性能为一体。实验室制备K2FeO4的方法如下:在冰水浴中,向KClO和KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌。
①在冰水浴中,向KClO和KOH的混合溶液中少量多次加入硝酸铁,生成高铁酸钾,Fe3+从+3价升高到+6价的FeO42-,失去3个电子,ClO-中氯元素从+1价变为-1价的氯离子,得到2个电子,最小公倍数为6,则ClO-和Cl-的系数为3,Fe3+和FeO42-系数为2,根据物料守恒,可得离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,
答案为:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;
②净水过程中,FeO42-发挥氧化作用,被还原成Fe3+,Fe3+水解生成Fe(OH)3胶体,起到吸附、絮凝作用,
答案为:净水过程中,FeO42-发挥氧化作用,被还原成Fe3+,Fe3+水解生成Fe(OH)3胶体,起到吸附、絮凝作用。


科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是
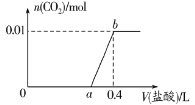
A.在0~a范围内,只发生中和反应
B.a=0.2
C.ab段发生反应的离子方程式为CO32-+2H+=CO2↑+H2O
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
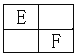
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
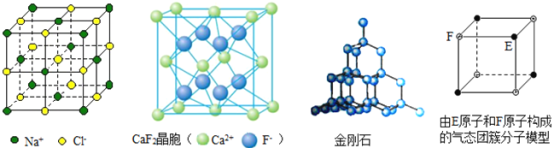
A. 在NaCl晶体中,距Na+最近的Cl-有6个
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计了四种实验方案并得出了自己的结论,其中实验方案设计及结论均正确的是( )
A. 淀粉溶液![]() 水解液溶液
水解液溶液![]() 变蓝。结论:淀粉完全没有水解
变蓝。结论:淀粉完全没有水解
B. 淀粉溶液![]() 水解液
水解液![]() 无砖红色沉淀。结论:淀粉完全水解
无砖红色沉淀。结论:淀粉完全水解
C. 淀粉溶液![]() 水解液
水解液![]() 中和液
中和液![]() 有砖红色沉淀。结论:淀粉已水解
有砖红色沉淀。结论:淀粉已水解
D. 淀粉溶液![]() 水解液
水解液![]() 无现象。结论:淀粉没有水解
无现象。结论:淀粉没有水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求写出反应的化学方程式:
(1)甲苯(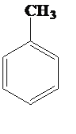 )在光照条件下和氯气发生一取代反应的化学方程式:_______________
)在光照条件下和氯气发生一取代反应的化学方程式:_______________
(2)以甲苯为原料制备邻氯甲苯(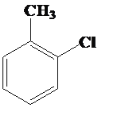 )的化学方程式:__________
)的化学方程式:__________
(3)以丙烯(![]() )为原料可以合成甘油(丙三醇,
)为原料可以合成甘油(丙三醇,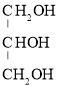 ),其合成步骤如下:
),其合成步骤如下:
![]() ___________
___________![]() 1,2,3-三氯丙烷
1,2,3-三氯丙烷![]() 丙三醇
丙三醇
己知:![]()
请写出第②步反应的化学方程式:___________________
(4)今有甲苯和丙三醇的混合物,测得其中H含量为a%,则![]() ___________(小数点后保留1位)
___________(小数点后保留1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是( )

A. 离O点越远的元素原子半径越大
B. 虚线相连的元素处于同一族
C. N点代表的是图中金属性最强的元素
D. M、N点代表的元素组成的化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象不能充分说明相应的化学反应是放热反应的是
选项 | A | B | C | D |
反应装置或图像 |
|
|
|
|
实验现象或图像信息 | 反应开始后,针筒活塞向右移动 | 反应开始后,甲侧液面低于乙侧液面 | 温度计的水银柱上升 | 反应开始后,气球慢慢胀大 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为_______________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
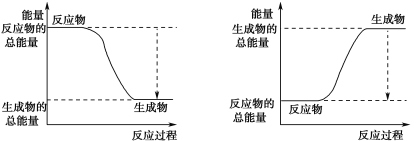
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,在元素周期表中处于如图位置的元素性质往往相似。由此推测下面有关锂及其化合物的性质的叙述错误的是( )
A.锂在过量氧气中燃烧,主要产物是Li2O而不是Li2O2
B.在相同温度下,溶解度Li2CO3小于LiHCO3
C.Li2CO3受热很难分解
D.少量的锂保存在石蜡中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com