
【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为_______________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
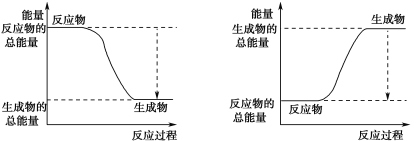
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止
【答案】 1.2×10-3 mol·L-1·s-1 30% 46 A b d
【解析】
(1)0~50s内生成氨气0.24mol,浓度是0.24mol÷2L=0.12mol/L,则平均反应速率v(NH3)=0.12mol/L÷50s=2.4×10-3mol/(L·s)。反应速率之比是化学计量数之比,则v(N2)=1.2×10-3mol/(L·s);
(2)250s时,生成了氨气0.4mol,根据方程式可知反应的氢气的物质的量为0.6mol,所以H2的转化率为0.6mol/2mol×100%=30%;
(3)反应热对断键吸收的能量和形成化学键所放出的能量的差值,则根据反应方程式N2+3H2![]() 2NH3可知△H=(946kJ/mol+3×436kJ/mol)-6×391kJ/mol=-92 kJ/mol,因此生成1molNH3过程中的热量变化为0.5×92 kJ=46 kJ,该反应为放热反应,反应物总能量高于生成物总能量,答案选A;
2NH3可知△H=(946kJ/mol+3×436kJ/mol)-6×391kJ/mol=-92 kJ/mol,因此生成1molNH3过程中的热量变化为0.5×92 kJ=46 kJ,该反应为放热反应,反应物总能量高于生成物总能量,答案选A;
(4)a.降低温度,反应速率减慢,
a错误;b.增大压强,反应速率加快,b正确;
c.恒容时充入He气,反应物的浓度不变,反应速率不变,c错误;
d.恒压时充入He气,反应物的浓度减小,反应速率减慢,d错误;
e.及时分离NH3,生成物的浓度减小,反应速率减慢,e测。
答案选b;
(5)a.使用催化剂,反应速率加快,提高了生产效率,a正确;
b.反应为可逆反应,N2不可能100%转化为NH3,b正确;
c.反应为可逆反应,在一定条件下,合成氨反应有一定的限度,c正确;
d.250~350s生成物浓度保持不变,反应达到了化学平衡状态,但反应未停止,d错误;
答案选d。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列关于钠的叙述中,正确的是( )
A.钠是银白色金属,熔点低,硬度大
B.钠放置于空气中,会迅速被氧化而生成淡黄色的氧化钠
C.在氧气中加热时,金属钠剧烈燃烧,火焰呈黄色
D.金属钠着火可以用水灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图I的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法不正确的是
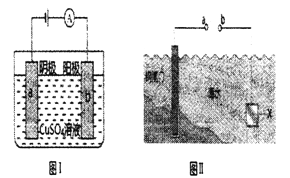
A. 图I中SO42-向b极移动
B. 图I中a为纯铜
C. 图Ⅱ中如果a、b间连接电源,则a连接负极
D. 图Ⅱ中如果a、b间用导线连接,则X可以是铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示下列描述正确的是

A. 反应开始到10s,用Z表示的反应速率为0.158 mol/(Ls)
B. 反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C. 反应开始到10s,Y的转化率为79.0 %
D. 反应的化学方程式为:X+Y![]() Z
Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”正成为科学家研究的主要课题。将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g) + 6H2(g) ![]() CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
(1) 已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如下图:
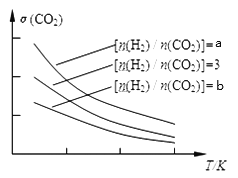
①a、3、b的大小关系___________
②请根据下图中信息在下图(右)中画出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的能量关系曲线___________。
(2)某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,上述反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的______
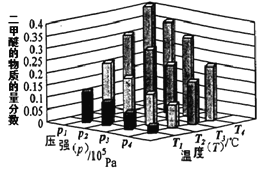
A. P3>P2,T3>T2 B. P1>P3,T1>T3 C. P2>P4,T4>T2 D. P1>P4,T2>T3
(3)在恒容密闭容器里按体积比为1:3充入CO2(g)和H2(g),一定条件下上述反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___________
A. 正反应速率先增大后减小 B. 逆反应速率先增大后减小
C. 化学平衡常数K值增大 D. 反应物的浓度增大
(4)下列一定能说明上述反应达到平衡的是___________
A.气体的平均摩尔质量不变
B.恒容条件下,气体的密度不变
C.各物质的速率之比等于系数比
D.[n(H2)/n(CO2)]不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是

A. Y的原子半径比X的大
B. Q的最高价氧化物的水化物的酸性比Z的强
C. Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
D. X、Y和氢3种元素形成的化合物中都只有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的稀溶液,不用其他试剂就能一一区别开来的是( ) ①Na2SO4、BaCl2、K2CO3、KNO3
②NaCl、AgNO3、Na2CO3、CaCl2
③CuSO4、BaCl2、NaOH、NaCl
④MgSO4、Na2CO3、Ba(NO3)2、H2SO4 .
A.①
B.②
C.③
D.④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com