
【题目】下列氯化物中,既能由金属和氯气直接反应得到,又能由金属和盐酸反应制得的是( )
A.FeCl2
B.AlCl3
C.FeCl3
D.CuCl2
科目:高中化学 来源: 题型:
【题目】NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为一类物质,下列分类标准不正确的是( )
A.钠的化合物
B.可与硝酸反应
C.可溶于水
D.电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组均为两种化合物溶于水时电离出的离子,其中由酸电离的是( )
A.Na+、OH﹣、SO42﹣
B.H+、Cl﹣、SO42﹣
C.Na+、K+、OH﹣
D.Na+、K+、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池作为安全性能较好的一类化学电源得到了更快的发展,一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,工作时产生稳定无污染的物质。下列说法正确的是
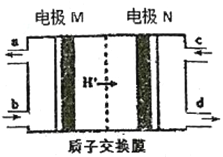
A. 正极的电极反应式为:O2+2H2O+4e-=4OH-
B. 负极上每消耗1molN2H4,会有2molH+通过质子交换膜
C. M极生成氮气且电极附近pH降低
D. d口流出的液体是蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置完成对应的实验,能达到实验目的的是
A. 制取并收集少量氨气 
B. 比较NaHCO3和Na2CO3的热稳定性
C. 制取并检验乙烯
D. 比较盐酸、碳酸、硅酸的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为_______________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
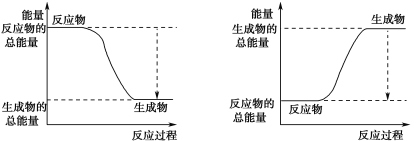
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的短周期元素,A元素气态氢化物的水溶液呈碱性,B为最活泼的非金属元素,C元素原子的电子层数是最外层电子数的3倍,D元素最高化合价为+6价。
(1)A元素气态氢化物的电子式为______;B在元素周期表中的位置为________。
(2)DBn做制冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的制冷剂。该物质的摩尔质量为146 g·mol-1,则该物质的化学式为_____。已知DBn在温度高于45℃时为气态,DBn属于____晶体。该物质被称为人造惰性气体,目前广泛应用于电器工业,在空气中不能燃烧,请从氧化还原角度分析不能燃烧的理由_________。
(3)C与氢元素组成1∶1的化合物,与水发生剧烈反应生成碱和一种气体,写出该反应的化学反应方程式____________,生成1mol气体转移的电子的数目为______个。
(4)A和C两元素可形成离子化合物甲。取13.0g化合物甲,加热使其完全分解,生成A的单质和C的单质,生成的A单质气体折合成标准状况下的体积为6.72L。化合物甲分解的化学方程式为______________________________。
(5)D元素的+4价含氧酸钠盐在空气中容易变质,设计实验方案证明该盐已经变质____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法不正确的是

A. a为铁钉,b为石墨
B. 阴极主要发生反应:2H2O + 2e-=== H2↑+ 2OH-
C. 高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-=== FeO42-+ 4H2O
D. 制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。

回答下列问题:
(1)操作B是______________(填实验基本操作名称)。
(2)操作B需加入下列试剂中的一种,最合适的是_________。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)工业上制取金属镁时是电解熔MgCl2,电解反应方程式为_________________。
(4)上图中虚线框内流程的主要作用是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com