
【题目】下列各组均为两种化合物溶于水时电离出的离子,其中由酸电离的是( )
A.Na+、OH﹣、SO42﹣
B.H+、Cl﹣、SO42﹣
C.Na+、K+、OH﹣
D.Na+、K+、NO3﹣
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z 在周期表中的相对位置如图所示。已知: Y的最高价氧化物对应的水化物既能与强碱反应,又能与强酸反应。下列说法不正确的是
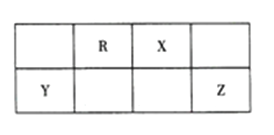
A. 简单气态氢化物的热稳定性: R<X
B. Y、Z的简单离子在同一溶液中能大量共存
C. 工业上,采用电解法冶炼单质Y
D. RZ2是含极性键的共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明溶液中:Ca2+、Cu2+、Br-、Cl-
B. 能使酚酞变红的溶液中:K+、Na+、CO![]() 、AlO2-
、AlO2-
C. c(ClO-)=1mol·L-1的溶液中:Fe2+、Al3+、NO3-、I-
D.  =0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
=0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:I2+2 S2O32-![]() S4O62-+2I-。相关物质的溶度积常数见下表:
S4O62-+2I-。相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl22H2O晶体,加入________;调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_____________;过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl22H2O晶体。
(2)在空气中直接加热CuCl22H2O晶体得不到纯的无水CuCl2,原因是________________。(用化学方程式表示)。由CuCl22H2O晶体得到纯的无水CuCl2的合理方法是_______________。
(3)某学习小组用“间接碘量法”测定含有CuCl22H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。已知:CuCl2溶液与KI反应的离子方程式为Cu2+ + 4I- = 2CuI↓ + I2
①可选用___________作滴定指示剂,滴定终点的现象是_________________。
②该试样中CuCl22H2O的质量百分数为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】易混易错题组
物质在水中可能存在电离平衡、盐类的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学的知识回答:
(1)A为0.1 molL-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________________________________________________。
(2)B为0.1 molL-1 NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(共3个,分别用离子方程式表示):_____________________________________________
(3)C为Al2(SO4)3溶液,实验室中配制Al2(SO4)3溶液时通常需要向其中加入_______________,若把B和C溶液混合,将产生白色沉淀和无色气体,该反应的离子方程式为___________________。
(4)pH=2的某酸HnA(An-为酸根)与pH=12的某碱B(OH)m混合,恰好反应生成正盐,混合液pH=8,反应生成的正盐的化学式为_________,盐中________离子一定能水解,其第一步水解的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图I的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法不正确的是
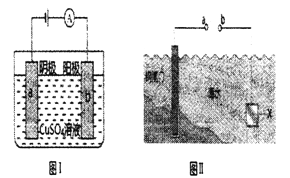
A. 图I中SO42-向b极移动
B. 图I中a为纯铜
C. 图Ⅱ中如果a、b间连接电源,则a连接负极
D. 图Ⅱ中如果a、b间用导线连接,则X可以是铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,可以说明反应P(g)+Q(g)![]() R(g)+T(g)在恒温下已经达到平衡的是( )
R(g)+T(g)在恒温下已经达到平衡的是( )
A. 反应容器内的压强不随时间变化
B. 反应容器内P、Q、R、T四者共存
C. P和T的生成速率相等
D. 反应容器内混合物的总物质的量不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸是常用的防腐剂和重要的医药原料。一种药用苯甲酸的制备方法如下:
Ⅰ.在反应罐中加入甲苯、饱和KMnO4溶液、Fe2O3(催化剂),加热、回流数小时,充分反应。
Ⅱ.反应结束后,改为蒸馏装置。加热蒸馏,直至冷凝管壁不再出现油珠。
Ⅲ.将反应罐中的混合物趁热过滤,滤渣用少量热水洗涤。
Ⅳ.向滤液中滴加浓盐酸酸化至pH=2,抽滤,用少量水洗涤,干燥得苯甲酸粗品。
Ⅴ.将粗苯甲酸加入……,结晶、洗涤、过滤,得到药用纯苯甲酸。
已知:相关物质的溶解度(g/mL)
温度(℃) | 25 | 50 | 60 | |
苯甲酸 | 在水中 | 0.0034 | 0.0085 | 0.0095 |
在乙醇中 | 0.4 | 0.7 | 1 | |
氯化钾 | 在乙醇中 | 难溶 | ||
(1)Ⅰ中发生的主要反应为:![]() (未配平),则Ⅳ中发生反应的离子方程式为______。
(未配平),则Ⅳ中发生反应的离子方程式为______。
(2)Ⅱ中蒸馏的目的是______。
(3)Ⅲ中趁热过滤的目的是______。
(4)将Ⅴ中操作补充完整:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com