
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明溶液中:Ca2+、Cu2+、Br-、Cl-
B. 能使酚酞变红的溶液中:K+、Na+、CO![]() 、AlO2-
、AlO2-
C. c(ClO-)=1mol·L-1的溶液中:Fe2+、Al3+、NO3-、I-
D.  =0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
=0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
科目:高中化学 来源: 题型:
【题目】能用H++OH-=H2O表示的是( )
A.NaOH溶液和H2CO3的反应B.氨水和稀H2SO4的反应
C.Ba(OH)2溶液和稀H2SO4的反应D.KOH溶液和盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有H2RO4=H++HRO4-、HRO4-![]() H++RO42-,现有物质的量浓度都为0.1mol/L的三种溶液:①NaHRO4溶液; ②H2RO4溶液; ③Na2RO4溶液。下列说法正确的是
H++RO42-,现有物质的量浓度都为0.1mol/L的三种溶液:①NaHRO4溶液; ②H2RO4溶液; ③Na2RO4溶液。下列说法正确的是
A. ②和③等体积混合后的溶液中: c( Na+)= c( HRO4-)+c(H2RO4) +c(RO42-)
B. 100mL①溶液中: n(HRO4-)+n(RO42-)+n(OH-)-n(H+)= 0.01
C. ①和②等体积混合后的溶液中可能的离子浓度为c( HRO4-)>c(H+)>c(Na+)
D. 若①和③等体积混合后,会抑制水的电离,则HRO4-的电离程度肯定大于RO42-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为一类物质,下列分类标准不正确的是( )
A.钠的化合物
B.可与硝酸反应
C.可溶于水
D.电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.950 mL,111.2 g
B.500 mL,117 g
C.1 000 mL,117 g
D.任意规格,111.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4FeO42-+10H2O=4Fe(OH)3↓+8OH-+3O2↑ ,测得c(FeO42-)在不同条件下变化如图甲、乙、丙、丁所示:
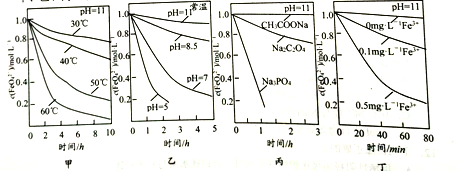
下列说法正确的是
A. 图甲表明,其他条件相同时,温度越低FeO42-转化速率越快
B. 图乙表明,其他条件相同时,碱性越强FeO42-转化速率越快
C. 图丙表明,其他条件相同时,钠盐都是FeO42-优良的稳定剂
D. 图丁表明,其他条件相同时,碱性条件下Fe3+能加快FeO42-的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]是重要的无机化工产品。一种由白云石[主要成分为CaMg(CO3)2,还含少量SiO2、Fe2O3等]为原料制备碱式碳酸镁(国家标准中CaO的质量分数≤0.43%)的实验流程如下:
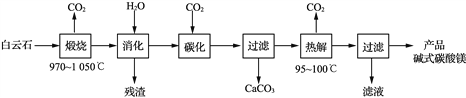
(1) “煅烧”时发生主要反应的化学方程式为____________________________。
(2)常温常压下“碳化”可使镁元素转化为Mg(HCO3)2,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
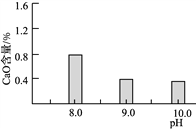
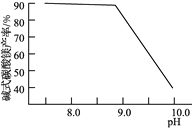
图1 CaO含量与碳化终点pH的关系 图2 碱式碳酸镁产率与碳化终点pH的关系
①应控制“碳化”终点pH约为________,发生的主要反应的化学方程式为______________________和____________________。
②图2中,当pH=10.0时,镁元素的主要存在形式是____________(写化学式)。
(3)“热解”生成碱式碳酸镁的化学方程式为________________________________。
(4)该工艺为达到清洁生产,可以循环利用的物质是____________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组均为两种化合物溶于水时电离出的离子,其中由酸电离的是( )
A.Na+、OH﹣、SO42﹣
B.H+、Cl﹣、SO42﹣
C.Na+、K+、OH﹣
D.Na+、K+、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的短周期元素,A元素气态氢化物的水溶液呈碱性,B为最活泼的非金属元素,C元素原子的电子层数是最外层电子数的3倍,D元素最高化合价为+6价。
(1)A元素气态氢化物的电子式为______;B在元素周期表中的位置为________。
(2)DBn做制冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的制冷剂。该物质的摩尔质量为146 g·mol-1,则该物质的化学式为_____。已知DBn在温度高于45℃时为气态,DBn属于____晶体。该物质被称为人造惰性气体,目前广泛应用于电器工业,在空气中不能燃烧,请从氧化还原角度分析不能燃烧的理由_________。
(3)C与氢元素组成1∶1的化合物,与水发生剧烈反应生成碱和一种气体,写出该反应的化学反应方程式____________,生成1mol气体转移的电子的数目为______个。
(4)A和C两元素可形成离子化合物甲。取13.0g化合物甲,加热使其完全分解,生成A的单质和C的单质,生成的A单质气体折合成标准状况下的体积为6.72L。化合物甲分解的化学方程式为______________________________。
(5)D元素的+4价含氧酸钠盐在空气中容易变质,设计实验方案证明该盐已经变质____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com