
����Ŀ���������dz��õķ���������Ҫ��ҽҩԭ�ϡ�һ��ҩ�ñ�������Ʊ��������£�
���ڷ�Ӧ���м���ױ�������KMnO4��Һ��Fe2O3�������������ȡ�������Сʱ����ַ�Ӧ��
��Ӧ������Ϊ����װ�á���������ֱ�������ܱڲ��ٳ������顣
����Ӧ���еĻ������ȹ��ˣ�������������ˮϴ�ӡ�
��������Һ�еμ�Ũ�����ữ��pH=2�����ˣ�������ˮϴ�ӣ�����ñ������Ʒ��
�������ֱ�������롭�����ᾧ��ϴ�ӡ����ˣ��õ�ҩ�ô������ᡣ
��֪��������ʵ��ܽ����g/mL��
�¶ȣ����� | 25 | 50 | 60 | |
������ | ��ˮ�� | 0.0034 | 0.0085 | 0.0095 |
���Ҵ��� | 0.4 | 0.7 | 1 | |
�Ȼ��� | ���Ҵ��� | ���� | ||
��1�����з�������Ҫ��ӦΪ��![]() ��δ��ƽ��������з�����Ӧ�����ӷ���ʽΪ______��
��δ��ƽ��������з�����Ӧ�����ӷ���ʽΪ______��
��2�����������Ŀ����______��
��3�����г��ȹ��˵�Ŀ����______��
��4�������������������______��
���𰸡� 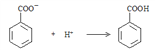 ��OH�� + H+ === H2O ��ȥ�д�ļױ� ���ٱ�����ؽᾧ������������ʧ һ��������Ҵ��У����60��ı�����Һ�����ˣ���Һ����������һ������ˮ��
��OH�� + H+ === H2O ��ȥ�д�ļױ� ���ٱ�����ؽᾧ������������ʧ һ��������Ҵ��У����60��ı�����Һ�����ˣ���Һ����������һ������ˮ��
����������1�����з�������Ҫ��ӦΪ��![]() ��δ��ƽ�������������Һ�еμ�Ũ�����ữ��pH=2��������Ӧ�����ӷ���ʽΪ
��δ��ƽ�������������Һ�еμ�Ũ�����ữ��pH=2��������Ӧ�����ӷ���ʽΪ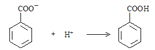 ��OH�� + H+ === H2O��
��OH�� + H+ === H2O��
��2����Ӧ������У����ķе�ϵͣ����Ԣ��������Ŀ���dz�ȥ�д�ļױ���
��3����Ϊ�¶�Խ�ͣ���������ܽ��ԽС�����Ԣ��г��ȹ��˵�Ŀ���Ǽ��ٱ�����ؽᾧ������������ʧ��
��4�����в�����Ϊ���ᴿ�����ᣬ��ȥ���е��Ȼ������ʣ�����������Ϣ��֪��������������Ҵ������Ȼ������ܣ����Կ��Ը���������ʾ����������ᴿ���������ֱ��������һ��������Ҵ��У����60��ı�����Һ�����ˣ���Һ����������һ������ˮ�У��ᾧ��ϴ�ӡ����ˣ��õ�ҩ�ô������ᡣ


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����Ϊ���ֻ���������ˮʱ����������ӣ��������������ǣ� ��
A.Na+��OH����SO42��
B.H+��Cl����SO42��
C.Na+��K+��OH��
D.Na+��K+��NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��DΪԭ��������������Ķ�����Ԫ�أ�AԪ����̬�⻯���ˮ��Һ�ʼ��ԣ�BΪ����õķǽ���Ԫ�أ�CԪ��ԭ�ӵĵ��Ӳ�����������������3����DԪ������ϼ�Ϊ+6�ۡ�
(1)AԪ����̬�⻯��ĵ���ʽΪ______��B��Ԫ�����ڱ��е�λ��Ϊ________��
(2)DBn�������������������Գ�������ȫû���ƻ����ã���һ�ֺ��з�չDZ����������������ʵ�Ħ������Ϊ146 g��mol-1��������ʵĻ�ѧʽΪ_____����֪DBn���¶ȸ���45��ʱΪ��̬��DBn����____���塣�����ʱ���Ϊ����������壬Ŀǰ�㷺Ӧ���ڵ�����ҵ���ڿ����в���ȼ�գ����������ԭ�Ƕȷ�������ȼ�յ�����_________��
(3)C����Ԫ�����1��1�Ļ������ˮ�������ҷ�Ӧ���ɼ��һ�����壬д���÷�Ӧ�Ļ�ѧ��Ӧ����ʽ____________������1mol����ת�Ƶĵ��ӵ���ĿΪ______����
(4)A��C��Ԫ�ؿ��γ����ӻ�����ס�ȡ13.0g������ף�����ʹ����ȫ�ֽ⣬����A�ĵ��ʺ�C�ĵ��ʣ����ɵ�A���������ۺϳɱ�״���µ����Ϊ6.72L��������ֽ�Ļ�ѧ����ʽΪ______________________________��
(5)DԪ�ص�+4�ۺ����������ڿ��������ױ��ʣ����ʵ�鷽��֤�������Ѿ�����____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�Na2FeO4���Ǿ�����ɫ����ķ�ĩ����һ�ָ�Ч��ɫǿ�������������������ȶ��������ڷ�ˮ��������ˮ�Ĵ�����ʵ������ʯī������Ϊ�缫���Բ�ͬŨ�ȵ�NaOH��ҺΪ�������Һ������һ����ѹ����Ʊ��������ƣ����װ�ú�����������
c(NaOH) | �������� | �������� |
1 mol��L��1 | ������ɫ���� | ������ɫ���壬10min����Һ��ɫ�����Ա仯 |
10 mol��L��1 | ����������ɫ���� | ����������ɫ���壬3min����Һ��Ϊdz�Ϻ�ɫ��������� |
15 mol��L��1 | ����������ɫ���� | ����������ɫ���壬1min����Һ��Ϊdz�Ϻ�ɫ��������� |
����˵������ȷ����

A. aΪ������bΪʯī
B. ������Ҫ������Ӧ��2H2O + 2e��=== H2��+ 2OH��
C. ��Ũ�ȵ�NaOH��Һ�������ڷ���Fe��6e��+ 8OH��=== FeO42��+ 4H2O
D. �Ʊ�Na2FeO4ʱ�����ñ���NaCl��Һ������Ч����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��2SO3(g)![]() 2SO2(g)+O2(g)�������仯ͼ����ͼ�ó������������ȷ����( )
2SO2(g)+O2(g)�������仯ͼ����ͼ�ó������������ȷ����( )
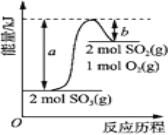
A. �û�ѧ��Ӧ�����м������������������������ͷ�
B. 2SO3(g)![]() 2SO2(g)+O2(g) ��H����(a��b) kJ��mol
2SO2(g)+O2(g) ��H����(a��b) kJ��mol
C. 1 mol SO2��������1 mol SO3��������
D. ��ij��������2 mol SO3��ַ�Ӧ������(a��b) kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��д���Ba2+��H+��NO3-����Һ�У������ܴ��������������
A. SO42- B. I- C. HCO3- D. NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�Ǿ����Դ���⡣��ͼ������Ӻ�ˮ��Դ��ȡijЩ��Ҫ����ԭ�ϵ�����ʾ��ͼ��

�ش��������⣺
(1)����B��______________(��ʵ�������������)��
(2)����B����������Լ��е�һ�֣�����ʵ���_________��
a.����������Һ b.����ʯ��ˮ c.ʯ���� d.̼������Һ
(3)��ҵ����ȡ����þʱ�ǵ����MgCl2����ⷴӦ����ʽΪ_________________��
(4)��ͼ�����߿������̵���Ҫ������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ճ�����л��ϳ�����;�㷺��ij�о�С���о������ڸ����������ѽⷴӦ��ԭ������Ӧ�á�
(1)��֪CH4(g)+2O2(g)=CO2(g)+2H2O ��H=- Q1kJ��mol-1
C2H2(g)+O2(g)=2CO2(g)+H2O(l) ��H=- Q2kJ��mol-1
H2(g)+ ![]() O2=(g)=H2O(l) ��H=- Q3kJ��mol-1
O2=(g)=H2O(l) ��H=- Q3kJ��mol-1
����������ѽⷴӦ��2CH4(g)=C2H2(g)+3H2(g)�ġ�H=____________kJ��mol-1
(2)���о�С�����о������еó�������ֽ�ʱ����������ƽ��ʱ��ѹ(Pa)���¶�(��)�Ĺ�ϵ��ͼ��ʾ��
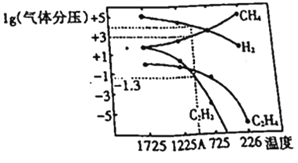
��T1��ʱ����2L�����ܱ������г���0.3molCH4��������Ӧ2CH4(g) ![]() C2H6(g)+2H2 (g)���ﵽƽ��ʱ�����c(C2H4)=c(CH4)���÷�Ӧ�ﵽƽ��ʱ��CH4��ת����Ϊ_________________��
C2H6(g)+2H2 (g)���ﵽƽ��ʱ�����c(C2H4)=c(CH4)���÷�Ӧ�ﵽƽ��ʱ��CH4��ת����Ϊ_________________��
�ڶ�����ƽ��״̬�����ı��¶���T2�棬��10s���ٴδﵽƽ�⣬c(CH4)=2c(C2H4)����10s��C2H4ƽ����Ӧ����r(C2H4) =__________�������仯������T1______T2(�>����<��)���ж�������_________________��
�۶��������з�����2CH4(g)![]() C2H2(g)+3H2(g)����ʽ����÷�Ӧ��ͼ��A���¶�ʱ��ƽ�ⳣ��K_____(��ƽ���ѹ����ƽ��Ũ��)��(��֪1g0.05=-1.3)����ֻ�ı�һ����Ӧ����ʹ�÷�Ӧ��ƽ�ⳣ����Kֵ�����������ǣ�_________(�����)
C2H2(g)+3H2(g)����ʽ����÷�Ӧ��ͼ��A���¶�ʱ��ƽ�ⳣ��K_____(��ƽ���ѹ����ƽ��Ũ��)��(��֪1g0.05=-1.3)����ֻ�ı�һ����Ӧ����ʹ�÷�Ӧ��ƽ�ⳣ����Kֵ�����������ǣ�_________(�����)
A.���ܼ�С��C2H2��Ũ�� B.һ�����������¶�
C.���������˷�Ӧ��ϵ��ѹǿ D.����ʹ���˴���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com