
【题目】下图是2SO3(g)![]() 2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
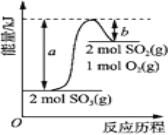
A. 该化学反应过程中既有能量的吸收又有能量的释放
B. 2SO3(g)![]() 2SO2(g)+O2(g) △H=-(a-b) kJ/mol
2SO2(g)+O2(g) △H=-(a-b) kJ/mol
C. 1 mol SO2的能量比1 mol SO3的能量高
D. 若某容器内有2 mol SO3充分反应,吸收(a-b) kJ热量
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】易混易错题组
物质在水中可能存在电离平衡、盐类的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学的知识回答:
(1)A为0.1 molL-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________________________________________________。
(2)B为0.1 molL-1 NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(共3个,分别用离子方程式表示):_____________________________________________
(3)C为Al2(SO4)3溶液,实验室中配制Al2(SO4)3溶液时通常需要向其中加入_______________,若把B和C溶液混合,将产生白色沉淀和无色气体,该反应的离子方程式为___________________。
(4)pH=2的某酸HnA(An-为酸根)与pH=12的某碱B(OH)m混合,恰好反应生成正盐,混合液pH=8,反应生成的正盐的化学式为_________,盐中________离子一定能水解,其第一步水解的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A.氧化还原反应的本质是元素化合价发生了变化
B.所含元素化合价升高的反应物被氧化
C.得到电子的物质被氧化
D.氧化还原反应中,氧化剂和还原剂一定是两种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据分析,吸烟生成的物质至少有700多种,大部分为有毒有害物质,如尼古丁和苯并芘,前者的成人致死量约为40~60mg,相当于一包香烟产生的尼古丁的总量;后者是最强的致癌物之一。它们的结构简式如图所示,下列有关尼古丁或苯并芘的叙述正确的是

A. 尼古丁的分子式为C10H14N2
B. 尼古丁分子中的所有原子都在同一平面上
C. 苯并芘易溶于水
D. 苯并芘分子中含有苯环结构单元,是苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸是常用的防腐剂和重要的医药原料。一种药用苯甲酸的制备方法如下:
Ⅰ.在反应罐中加入甲苯、饱和KMnO4溶液、Fe2O3(催化剂),加热、回流数小时,充分反应。
Ⅱ.反应结束后,改为蒸馏装置。加热蒸馏,直至冷凝管壁不再出现油珠。
Ⅲ.将反应罐中的混合物趁热过滤,滤渣用少量热水洗涤。
Ⅳ.向滤液中滴加浓盐酸酸化至pH=2,抽滤,用少量水洗涤,干燥得苯甲酸粗品。
Ⅴ.将粗苯甲酸加入……,结晶、洗涤、过滤,得到药用纯苯甲酸。
已知:相关物质的溶解度(g/mL)
温度(℃) | 25 | 50 | 60 | |
苯甲酸 | 在水中 | 0.0034 | 0.0085 | 0.0095 |
在乙醇中 | 0.4 | 0.7 | 1 | |
氯化钾 | 在乙醇中 | 难溶 | ||
(1)Ⅰ中发生的主要反应为:![]() (未配平),则Ⅳ中发生反应的离子方程式为______。
(未配平),则Ⅳ中发生反应的离子方程式为______。
(2)Ⅱ中蒸馏的目的是______。
(3)Ⅲ中趁热过滤的目的是______。
(4)将Ⅴ中操作补充完整:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 按系统命名法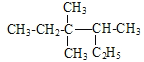 的名称为3,3-二甲基-2-乙基戊烷
的名称为3,3-二甲基-2-乙基戊烷
B. 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应
C. 分子式为C5H12O的醇共有8 种,其中能催化氧化成醛的同分异构体有3 种
D. 乙烯和苯均能使溴水因发生化学反应褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,能使电离平衡H2O![]() H++OH-向右移动且溶液呈酸性的是
H++OH-向右移动且溶液呈酸性的是
A. 向水中加入NaHSO4溶液 B. 将水加热到100℃,使pH=6
C. 向水中加入Na2CO3溶液 D. 向水中加入Al2(SO4)3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组模拟工业上海水提溴,设计如下实验。 回答下列问题:
Ⅰ. 利用如图所示装置富集溴:
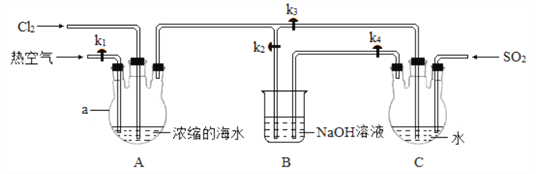
实验步骤:
①关闭 k1、k3,打开k2,向装置A 中通入足量Cl2,充分反应;
②停止通Cl2,关闭k2,打开 k1、k3 和k4, 向装置A 中通入足量热空气,同时向装置C中通入足量SO2,充分反应;
③停止通气体,关闭k1、k4。
(1)a 的名称为___________。
(2) 步骤①中主要反应的离子方程式为_____________。
(3) 步骤②中通入热空气的作用为_______。 装置 C 发生富集溴的反应中,氧化剂与还原剂的物质的量之比为____________;实际参加反应的SO2 的物质的量大于理论值,主要原因为_____________(用化学方程式表示)。
Ⅱ.制备溴:
富集溴的过程结束后,继续向装置 C 中通入 Cl2,充分反应后蒸馏。
(4)下列蒸馏装置正确的是_____(填选项字母)。

(5) 装置 A 中加入V mL 含 Br-的浓度为 c mol·L-1的浓缩海水,蒸馏所得溴单质的质量为 m g, 则该实验中溴单质的产率为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com