
【题目】两份等质量Na2O2和NaHCO3均匀混和物,向其中一份加入100mL盐酸,充分反应呈中性,放出气体经干燥后测得体积为2.24L(标准状况)。如将该气体通入另一混和物中充分反应后,气体体积变为2.016L(标准状况)。若混合物中NaHCO3的物质的量大于Na2O2。则:
(1)原混和物中Na2O2与NaHCO3的物质的量之比为__________________;
(2)加入盐酸的物质的量的浓度为_____________mol·L-1。
【答案】2︰91.3mol/L
【解析】
(1)根据题意,发生的反应有:①2Na2O2+4HCl=4NaCl+2H2O+O2,②NaHCO3+HCl=NaCl+H2O+CO2,③2Na2O2+2CO2=2Na2CO3+O2。
NaHCO3与盐酸反应产生CO2,Na2O2与盐酸反应生成O2,因此第一步反应生成的气体为二氧化碳和氧气的混合气体,2.24 L气体的物质的量为![]() =0.1 mol,即第一步反应生成二氧化碳和氧气共0.1mol。
=0.1 mol,即第一步反应生成二氧化碳和氧气共0.1mol。
CO2与Na2O2反应将产生O2,因为混合物中NaHCO3的物质的量大于Na2O2,故第两步反应后的剩余气体一定有O2和CO2,2.016 L气体的物质的量为![]() =0.09 mol,即第二步反应生成二氧化碳和氧气0.09mol,
=0.09 mol,即第二步反应生成二氧化碳和氧气0.09mol,
2Na2O2+2CO2=2Na2CO3+O2 △n(g)
0.02mol 0.02mol 0.01mol
n n 0.1mol-0.09mol=0.01mol
n(Na2O2)=0.02mol。
根据方程式①,第一份生成的O2为0.01mol,则CO2为0.1mol-0.01mol=0.09mol,因此碳酸氢钠为0.09mol,原混和物中Na2O2与NaHCO3的物质的量之比为0.02mol∶0.09mol=2∶9,故答案为:2∶9;
(2)2Na2O2 + 4HCl=4NaCl+2H2O+O2
0.02mol 0.04mol 0.01mol
NaHCO3 + HCl=NaCl+H2O+CO2
0.09mol 0.09mol 0.09mol
消耗的HCl为0.04mol+0.09mol=0.13mol,c(HCl)=![]() =1.3 mol/L,故答案为:1.3mol/L。
=1.3 mol/L,故答案为:1.3mol/L。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
【题目】元素①~⑧在元素周期表中的位置如下,回答有关问题:

(1)表中能形成两性氢氧化物的元素是(填元素符号)______,最不活泼的元素的原子结构示意图为________。
(2)③号元素和⑧号元素的气态氢化物中,热稳定性较强的是(填化学式)________
(3)④号元素和⑥号元素的离子半径较大的是(填离子符号)_______
(4)上述元素中,金属性最强的元素与非金属最强的元素形成化合物的化学式______
(5)②的氢化物发生催化氧化的化学方程式为___________。
(6)写出⑤号元素的最高价氧化物对应的水化物和⑧号元素的最高价氧化物对应的水化物发生反应的离子方程式_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g),0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是( )
H2(g)+I2(g),0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是( )
A. 容器中,反应平衡时的压强大于起始时的压强
B. c(HI)由0.07mol/L降到0.05mol/L所需的反应时间大于10s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 0~15s内用I2表示的平均反应速率为:v(I2)=0.002mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)含碳物质在日常生活与工业生产上有广泛的应用。
(1)一种熔融碳酸盐燃料电池原理示意如图1所示,写出电极A中发生的电极方程式_____;

(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见图2。在15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为______________(填序号)。

(3)以 TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。乙酸的生成速率主要取决于温度影响的范围是______________________;
(4)CO和H2在Cu2O/ZnO作催化剂的条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)获得甲醇。向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应合成甲醇,反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图4所示。
CH3OH(g)获得甲醇。向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应合成甲醇,反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图4所示。

①500℃的此反应的平衡常数K=________________;
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,原因是________________(用化学方程式表示)。
③在500℃恒压条件下,请在图4中画出反应体系中n(CH3OH)随时间t变化的总趋势图________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是
A. ρ=![]() B. w=
B. w=![]()
C. w=![]() D. c=
D. c=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( )

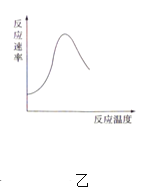


A. 图甲表示燃料燃烧反应的能量变化
B. 图乙表示酶催化反应的反应速率随反应温度的变化
C. 图丙表示除去氧化膜的镁条投入到稀盐酸中,反应速率v随时间t的变化曲线
D. 图丁表示某温度下V1mLl.0 mol/L HC1溶液和V2 mL1.5mol/L的NaOH溶液混合均匀后溶液温度随V1的变化趋势(V1+V2=50mL)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlN广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A. AlN为氧化产物
B. AlN的摩尔质量为41g
C. 上述反应中,每生成1molAlN需转移3mol电子
D. 上述反应中,N2是还原剂,Al2O3是氧化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com