
| A. | K+、SO42-、Ba2+ | B. | Na+、Ca2+、Cl- | C. | H+、OH-、NO3- | D. | H+、Na+、CO32- |
科目:高中化学 来源:2016-2017学年辽宁省高一上10月月考化学卷(解析版) 题型:选择题
下列有关气体体积的叙述正确的是
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积指1mol任何气体所占的体积,约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5Q2-1.5Q1-0.5Q3 | B. | 0.5(Q1+Q2+Q3) | ||
| C. | 0.5 Q1-1.5 Q2+0.5Q3 | D. | 1.5Q1-0.5Q2+0.5Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁烷的一氯代物有5种 | B. | 丙烷分子中所有原子共平面 | ||
| C. | 符合通式CnH2n+2的均属于烷烃 | D. | 以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
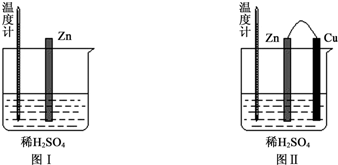
| 实验现象 | 解释原因 |
| Cu片上产生了大量气泡 | Zn、Cu构成原电池,H+在Cu片上得电子产生氢气 |
| 温度计指示的温度无明显变化 | 反应中的化学能主要转化成了电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
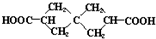 (也可表示为
(也可表示为 )是一种重要的药物中间体,现欲通过如下途径合成:
)是一种重要的药物中间体,现欲通过如下途径合成: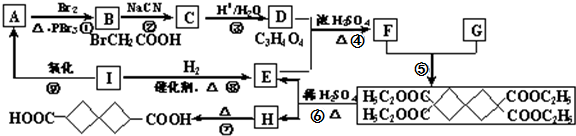
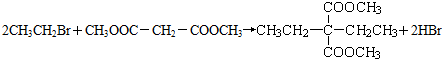
 ;该反应的类型是取代反应或水解反应.
;该反应的类型是取代反应或水解反应. -COOH,则X的结构简式为BrCH2CH2Br.
-COOH,则X的结构简式为BrCH2CH2Br.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
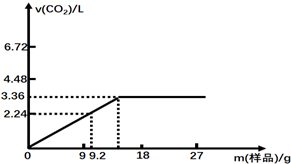
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1×10-7mol/L的溶液一定是酸性 | |
| B. | 标况时,水本身电离出的c(H+)=1×10-13的溶液,可能是0.1mol•L-1的盐酸或0.1mol•L-1的NaOH溶液 | |
| C. | BaSO4难溶于水,是强电解质 | |
| D. | NH3•H2O的水溶液导电,所以NH3是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com