
【题目】按要求填空
(1)键线式![]() 表示的分子式是 ;名称是 。
表示的分子式是 ;名称是 。
(2) 中含有的官能团的名称为 。
中含有的官能团的名称为 。
(3)化学式为C3H8O的醇在一定条件下能氧化成醛,写出此反应的化学方程式_________ __
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】中国是世界炼锌的发源地,宋应星著于明崇祯十年(1637年)的《天工开物》一书则是最早记述炼锌技术的典籍。回答下列问题:
Ⅰ.《天工开物》中有关于“升炼倭铅” 的记载:“炉甘石(碳酸锌)十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅(金属锌)也。”
(1)该炼锌工艺过程主要反应的化学方程式为 。
Ⅱ. 目前,工业上主要采用 “湿法炼锌”。以闪锌矿(主要成分为 ZnS ,含有FeS等杂质)为原料冶炼锌的工艺流程如下图所示。

(2)闪锌矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的成分的化学式为 。
(3)焙烧过程中产生的含尘烟气可净化制酸,该酸的名称是 。
工业上常采用“针铁矿法”净化浸出液,在80~100℃,Fe3+浓度低于1g/L,调节浸出液的pH在3~5之间,溶液中的铁可以呈针铁矿(FeOOH)的形式析出。
(4)浸出液的Fe3+浓度较高,应先加入SO2或ZnS将 ,再以ZnO调节酸度,在空气缓慢氧化得 Fe3+,最后Fe3+ 转化成针铁矿沉淀。Fe2+沉淀过程的总离子方程式为 。
(5)电解沉积锌是以Pb-Ag合金惰性电极作阳极、纯铝板作阴极,通以直流电,在 上析出金属锌,电解过程的化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题:

(1)图中A表示 E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”),
(2)图中△H= KJ·mol-1;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某实验室要用90mL1.00 mol·L-1的NaOH溶液。在配制该NaOH溶液的过程中:
①除了要使用托盘天平、药匙、烧杯、玻璃棒、胶头滴管,还要使用的仪器有 。
②需用托盘天平称取NaOH的质量为 g。
(2)从海带中提取碘的流程如下图:

①指出提取碘的过程中实验操作、操作的名称:c__________
②在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是
。(注:下图试管中深色区为紫红色溶液)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃,其球棍模型如下图:

(1)等质量的以上物质完全燃烧时耗去O2的量最多的是________(填对应字母,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是____________;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是________,生成水最多的是________。
(4)在120℃、1.01×105 Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是 (双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;
②再通入CO___________。
(5)该反应的逆反应速率随时间变化的关系如下图:
①从图中看到,反应在t2时达平衡, 在t1时改变了某种条件,改变的条件可能是(填序号)__ __。(单选)

A.升温 B.增大CO2浓度
②如果在t3时从混合物中分离出部分CO,t4~t5时间段反应处于新平衡状态,请在图上画出t3~t5的V(逆)变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)如图为1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图。已知E1=134KJ/mol,E2=368KJ/mol( E1、 E2为反应的活化能)。若在反应体系中加入催化剂,反应速率增大,则E1、△H的变化分别是 、 (填“增大”、“减小”或“不变”)。写出该 反应的热化学方程式 。
(2)若反应SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g)在150℃下能自发进行,则△H___0。
A.大于 B.小于 C.等于 D.大于或小于都可
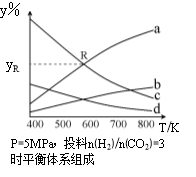
Ⅱ.以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) △H=QkJ/mol (Q>0)
CH3CH2OH(g)+3H2O(g) △H=QkJ/mol (Q>0)
在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如下图所示。完成下列填空:
(1)表示CH3CH2OH体积分数曲线的是____(选填序号)。
(2)在一定温度下反应达到平衡的标志是 。
A.平衡常数K不再增大
B.CO2的转化率不再增大
C.混合气体的平均相对分子质量不再改变
D.反应物不再转化为生成物
(3)其他条件恒定,达到平衡后,能提高H2转化率的措施是_______(选填编号)。
A.升高温度 B.充入更多的H2 C.移去乙醇 D.增大容器体积
(4)图中曲线a和c的交点R对应物质的体积分数yR=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮有不同价态的氧化物,如NO、N2O3、NO2, N2O5等,它们在一定条件下可以相互转化。
(1)己知:2NO(g)+O2(g) =2NO2(g)△H1=-113kJ/mol
NO(g)+O3(g)=NO2(g)+O2(g) △H2=-199 kJ/mol
4NO (g)+O2(g) =2N2O5(g) △H4=-57 kJ/mol
则反应6NO2 (g)+O3(g)=3N2O5(g) △H=__________。
(2)某温度下.在一体积可变的密闭容器中充入1mol N2O3,发生反应N2O3![]() NO2(g)+NO(g),达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图像如图所示,有关说法正确的是__________
NO2(g)+NO(g),达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图像如图所示,有关说法正确的是__________

A.t1时刻改变的条件是增大N2O3的浓度,同时减小NO2或NO的浓度
B.t1时刻改变条件后,平衡向正反应方向移动,N2O3的转化率增大
C.在t2时刻达到新的平衡后,NO2的百分含量不变
D.若t1时刻将容器的体积缩小至原容积的一半,则速率~时间图像与上图相同
(3)在1000K下,在某恒容容器中发生下列反应:2NO2(g) ![]() 2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图所示。图中a点对应温度下.己知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp= __________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图所示。图中a点对应温度下.己知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp= __________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).


(4)对于反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2 (NO2)。其中,k1、k2是与反应及温度有关的常数。相应的速率-压强关系如图所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的点__________,理由是__________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2 (NO2)。其中,k1、k2是与反应及温度有关的常数。相应的速率-压强关系如图所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的点__________,理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学―选修 3 物质结构与性质】
氮族元素(Nitrogen group)是元素周期表VA 族的所有元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)和Uup共计六种。
(1)氮族元素的外围电子排布式的通式为 ;基态磷原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 。
(2)PH3分子的VSEPR模型为______________,键角NH3 H2O(填“>”、“<”或“=”)。
(3)氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子中氮的杂化方式为 。
(4)从化合物NF3和NH3的结构与性质关系比较,回答它们两者如下性质差异原因:
①NF3的沸点为-129℃,而NH3的沸点为-33℃,其原因是 。
②NH3易与Cu2+反应,而NF3却不能,其原因是 。
(5)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层,磷化硼晶体的晶胞结构与金刚石类似,磷原子作面心立方最密堆积,则硼原子的配位数为________;已知磷化硼的晶胞边长a=" 478" pm,计算晶体中硼原子和磷原子的核间距(dB-P)=__________pm(保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com