
【题目】中国是世界炼锌的发源地,宋应星著于明崇祯十年(1637年)的《天工开物》一书则是最早记述炼锌技术的典籍。回答下列问题:
Ⅰ.《天工开物》中有关于“升炼倭铅” 的记载:“炉甘石(碳酸锌)十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅(金属锌)也。”
(1)该炼锌工艺过程主要反应的化学方程式为 。
Ⅱ. 目前,工业上主要采用 “湿法炼锌”。以闪锌矿(主要成分为 ZnS ,含有FeS等杂质)为原料冶炼锌的工艺流程如下图所示。

(2)闪锌矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的成分的化学式为 。
(3)焙烧过程中产生的含尘烟气可净化制酸,该酸的名称是 。
工业上常采用“针铁矿法”净化浸出液,在80~100℃,Fe3+浓度低于1g/L,调节浸出液的pH在3~5之间,溶液中的铁可以呈针铁矿(FeOOH)的形式析出。
(4)浸出液的Fe3+浓度较高,应先加入SO2或ZnS将 ,再以ZnO调节酸度,在空气缓慢氧化得 Fe3+,最后Fe3+ 转化成针铁矿沉淀。Fe2+沉淀过程的总离子方程式为 。
(5)电解沉积锌是以Pb-Ag合金惰性电极作阳极、纯铝板作阴极,通以直流电,在 上析出金属锌,电解过程的化学反应方程式为 。
【答案】(1)ZnCO3+2C![]() Zn+3CO↑(2)ZnO Fe2O3(3)硫酸
Zn+3CO↑(2)ZnO Fe2O3(3)硫酸
(4)其中的 Fe3+还原为Fe2+,4Fe2+ + O2 + 4ZnO + 2H2O = 4FeOOH + 4Zn2+
(5)阴,2ZnSO4 + 2H2O ![]() 2Zn + 2H2SO4 + O2↑
2Zn + 2H2SO4 + O2↑
【解析】
试题分析:(1)由题意可知:反应物为ZnCO3和C,产物含有Zn,化学方程式:ZnCO3+2C![]() Zn+3CO↑,故答案为:ZnCO3+2C
Zn+3CO↑,故答案为:ZnCO3+2C![]() Zn+3CO↑;
Zn+3CO↑;
(2)硫化锌精矿的焙烧可生成ZnO、氧化铁等,所以产生焙砂的主要成分的化学式为ZnO、Fe2O3,
故答案为:ZnO、Fe2O3;
(3)焙烧过程中产生的含尘烟气中含有二氧化硫,净化后可以用作硫酸工业的原料,故答案为:硫酸;
(4)浸出液的Fe3+浓度较高,应先加入SO2或ZnS将其中的 Fe3+还原为Fe2+,,再以ZnO调节酸度,在空气缓慢氧化得 Fe3+,最后Fe3+ 转化成针铁矿沉淀。Fe2+沉淀过程的总离子方程式为4Fe2+ + O2 + 4ZnO + 2H2O = 4FeOOH + 4Zn2+,故答案为:其中的 Fe3+还原为Fe2+,4Fe2+ + O2 + 4ZnO + 2H2O = 4FeOOH + 4Zn2+;
(5)电解沉积锌是以Pb-Ag合金惰性电极作阳极、纯铝板作阴极,通以直流电,在阴极上锌离子发生还原反应析出金属锌,阳极上水中的氢氧根离子放电生成氧气,电解过程的化学反应方程式为,故答案为:阴,2ZnSO4 + 2H2O ![]() 2Zn + 2H2SO4 + O2↑。
2Zn + 2H2SO4 + O2↑。


科目:高中化学 来源: 题型:
【题目】为了研究化学反应X+Y=Z的能量变化情况,某同学设计了如图所示装置。当向盛有X的试管中滴加试剂Y时,看到U型管中甲处液面下降乙处液面上升。试回答下列问题:
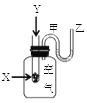
(1)该反应为______反应(填“放热”或“吸热”)。
(2)X和Y的总能量比Z的总能量_______(填“高”或“低”)。
(3)物质中的化学能通过_____转化成_______释放出来。
(4)反应物化学键断裂吸收的能量____于生成物化学键形成放出的能量(填“高”或“低”)。
(5)己知2mol氢气完全燃烧生成水蒸气时放出能量484kJ,且氧气中1molO=O键完全断裂时吸收能量496kJ,水蒸气中1molH-O键形成时放出能量463kJ,则氢气中1molH-H键断裂时吸收能量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如下图所示装置进行有关实验。

(1)装置A中发生反应的化学方程式为____________________________。
(2)装置D中试管口放置的棉花应浸一种溶液,这种溶液是________,其作用是________________________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是_______________,
(4)实验中,取一定质量的铜片和一定体积18 mol·L-1的浓硫酸放在圆底烧瓶中共热,反应完毕时,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余,其原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.等物质的量的O2和CO2所含氧原子数均为2NA
B.标准状况下,2.24 L一氯甲烷中含有氢原子数目为0.3NA
C.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA
D.6.8 g熔融的KHSO4中含有0.1 NA个阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白(涉及表中元素一律用对应化学符号表示):
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:________(填具体元素符号,下同),原子结构示意图为________。元素⑩名称为________在周期表中的位置________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是________,碱性最强的化合物的电子式是:________。
(3)用电子式表示元素④与⑥的化合物的形成过程:________________,该化合物属于________(填“共价”或“离子”)化合物。
(4)表示①与⑦的化合物的电子式________,该化合物是由________(填”极性”、“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是______________。
(6)元素③的氢化物的结构式为________;该氢化物常温下和元素⑦的单质反应的化学方程式为_________ _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+1/2O2(g)![]() CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
CO2(g)+2H2(g)能量变化如图,下列说法正确的是______

A.CH3OH转变成H2的过程是一个吸收能量的过程
B.H2的生成速率与CH3OH的消耗速率之比为1:2
C.化学变化不仅有新物质生成,同时也一定有能量变化
D.1 mol H—O键断裂的同时2 mol C=O键断裂,则反应达最大限度
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol·L-1,4min内平均反应速度v(H2)= ,则CH3OH的转化率为 。
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。则下列说法正确的是 。
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为CH3OH-6e-==CO2↑+2H2O
C.电池放电时,电解质溶液的碱性逐渐减弱
D.电池放电时每消耗6.4gCH3OH转移1.2 mol电子
(4)写出甲醇燃料电池在酸性条件下负极的反应式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上用FeCl3溶液刻蚀铜的线路板,反应为Cu+2FeCl3= CuCl2+ 2FeCl2 依据此氧化还原反应,设计成原电池。现给出铁棒、铜棒、石墨电极,原电池的负极为 ,正极电极反应方程式 ,若负极减重6.4克,则电路中转移电子的物质的量为 。
(2)在一密闭的2L的容器里装有4mol SO2和2mol O2,在一定条件下开始反应。2min末测得容器中共有5.6mol 气体,试计算:
(1)2min末SO3的浓度 。
(2)用SO2表示该反应的平均反应速率 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中(容积为2 L),充入氨气5 mol和氧气7.25 mol,并发生如下反应:4NH3+5O2 ![]() 4NO+6H2O(g),此反应在一定条件下进行2 min后达到平衡,测得NH3的物质的量为4 mol.
4NO+6H2O(g),此反应在一定条件下进行2 min后达到平衡,测得NH3的物质的量为4 mol.
(1)生成H2O(g)的物质的量为 ,以NO的浓度变化表示该反应的平均反应速率是_______。
(2)O2的平衡浓度是____________。
(3)NH3的转化率为 。
(4)写出平衡常数的表达式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)键线式![]() 表示的分子式是 ;名称是 。
表示的分子式是 ;名称是 。
(2) 中含有的官能团的名称为 。
中含有的官能团的名称为 。
(3)化学式为C3H8O的醇在一定条件下能氧化成醛,写出此反应的化学方程式_________ __
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com