
分析 (1)碘化钾和碘酸钾在酸性条件下能发生氧化还原反应生成碘,碘遇淀粉变蓝色,据此分析;
(2)IO3-+5I-+6H+═3I2+3H2O根据此反应方程式知,该反应需要酸性条件,需要碘离子,需要淀粉碘化钾试纸检验,据此判断选项;
解答 解:(1)碘化钾和碘酸钾在酸性条件下能发生氧化还原反应生成碘5KI+KIO3+6HCl=6KCl+3H2O+3I2;
该反应中KI是还原剂,还原剂对应的产物是氧化产物,KIO3是氧化剂,氧化剂对应的产物是还原产物,所以氧化产物、还原产物都是碘,物质的量之比为 5:1;
该反应中有碘单质生成,碘遇淀粉变蓝色,所以观察到溶液变蓝色.
故答案为:5KI+KIO3+6HCl=6KCl+3H2O+3I2; 5:1; 溶液变蓝色.
依题意:IO3-+5I-+6H+=3I2+3H2O;结合I2的特性----遇淀粉变蓝,要检验食盐中存在IO3-,
只需I-和酸溶液(即H+),生成的I2由淀粉检验,故选B.
点评 本题考查了物质的检验,氧化还原反应的概念分析,电子转移的计算应用,难度不大,会根据题中信息及物质的特殊性质选取试剂.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氢氧化钠溶液与盐酸反应:OH-+H+═H2O | |
| B. | H2SO4溶液中滴入Ba(OH)2溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| D. | 氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①③⑤ | C. | ②④⑤⑥ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
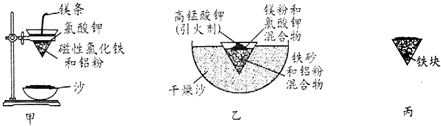
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3用作耐火材料、Al(OH)3用作阻燃剂 | |
| B. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| C. | 碳素钢的主要成分是铁碳合金、司母戊鼎的主要成分是铜锡合金 | |
| D. | 盛放NaOH溶液的磨口玻璃瓶要用橡胶塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
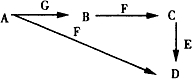 A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色的固体.它们的相互转化如图所示,部分生成物未列出.试回答下列问题
A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色的固体.它们的相互转化如图所示,部分生成物未列出.试回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
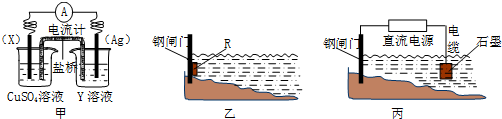
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com