
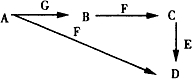
 A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色的固体.它们的相互转化如图所示,部分生成物未列出.试回答下列问题
A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色的固体.它们的相互转化如图所示,部分生成物未列出.试回答下列问题分析 A~G为中学化学中常见的物质,B、E、F为单质,F的一种氧化物常用作红色油漆和涂料,则F为Fe;在常温下B是一种有色气体,则B为Cl2;Fe和氯气反应生成氯化铁,则C为FeCl3;E在电气、电子工业应用最广,也是人类发现最早的金属之一,则E是Cu;
G为黑色的固体,浓盐酸和二氧化锰反应生成氯气,则G为MnO2、A为HCl,盐酸和Fe反应生成氯化亚铁,所以D为FeCl2,结合题目分析解答.
解答 解:A~G为中学化学中常见的物质,B、E、F为单质,F的一种氧化物常用作红色油漆和涂料,则F为Fe;在常温下B是一种有色气体,则B为Cl2;Fe和氯气反应生成氯化铁,则C为FeCl3;E在电气、电子工业应用最广,也是人类发现最早的金属之一,则E是Cu;
G为黑色的固体,浓盐酸和二氧化锰反应生成氯气,则G为MnO2、A为HCl,盐酸和Fe反应生成氯化亚铁,所以D为FeCl2,
(1)通过以上分析知,A为HCl、G为MnO2,故答案为:HCl;MnO2;
(2)F的一种氧化物常用作红色油漆和涂料,为氧化铁,这种氧化物的俗称为铁红,故答案为:铁红;
(3)Cu与FeCl3反应的离子方程式Cu+2Fe3+=2Fe2++Cu2+,利用电解法可提纯E物质,在该电解反应中阳极物质是粗铜,阴极物质是Cu,电解质溶液是硫酸铜,
故答案为:Cu+2Fe3+=2Fe2++Cu2+;粗铜;Cu;硫酸铜;
(4)将Cl与SO2等体积混合后,二者发生氧化还原反应生成硫酸和盐酸,所以通入品红溶液中,观察到的现象是品红不褪色,涉及的化学方程式为Cl2+SO2+2H2O=H2SO4+2HCl,工业上获得B的重要途径是电解饱和食盐水,反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,
故答案为:Cl2+SO2+2H2O=H2SO4+2HCl;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH.
点评 本题考查无机物推断,为高频考点,根据物质特殊元素、状态及其性质为突破口采用正逆结合的方法进行推断,知道氯气的实验室制法及其原理,注意(4)中如果氯气和二氧化硫等体积混合通入品红溶液中,则溶液不褪色,为易错点.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 该反应的化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g) | |
| B. | 上述反应的正反应是放热反应 | |
| C. | 若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830℃,该反应达到平衡状态时,生成CO2为0.4 mol | |
| D. | 若平衡浓度符合关系式$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,则此时的温度为1 000℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (△H2-△H3 ):2(△H1-△H3) | B. | (△H3-△H2 ):($\frac{△{H}_{1}}{2}$-△H3) | ||
| C. | (△H3-△H2 ):(△H3-$\frac{△{H}_{1}}{2}$) | D. | ($\frac{△{H}_{1}}{2}$-△H2 ):(△H3-△H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入足量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 水玻璃中加入稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ | |
| C. | 二氧化硅与苛性钠溶液反应:SiO2+OH-=SiO32-+H2O | |
| D. | 氧化铝与NaOH溶液反应:Al2O3+10OH-=2[Al(OH)4]-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ | B. | OH- | C. | Ag+ | D. | CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g/mol | B. | 32g/mol | C. | 64g/mol | D. | 128g/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com