
如图表示反应2 SO2(g)+ O2(g) 2 SO3(g) △H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是
A.t1时减小了SO2 的浓度,增加了SO3的浓度,平衡向逆反应方向移动
B.t1时降低了温度,平衡向正反应方向移动
C.t1时减小了压强,平衡向逆反应方向移动
D.t1时增加了SO2 和O2的浓度,平衡向正反应方向移动
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
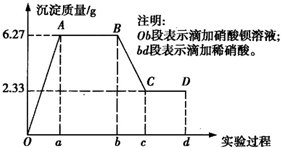 某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO
某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO2- 3 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
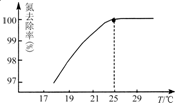 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.- 4 |
- 4 |
2- 4 |
2- 8 |
2- 8 |
+ 4 |
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 离子反应是中学化学中重要的反应类型.回答下列问题:
离子反应是中学化学中重要的反应类型.回答下列问题:| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为H++OH-═H2O | |
| ③离子方程式中凡是难溶性酸、碱、盐均要标“↓”符号 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
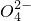 、NO
、NO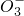 的相互分离.相应的实验过程可用如图表示:
的相互分离.相应的实验过程可用如图表示: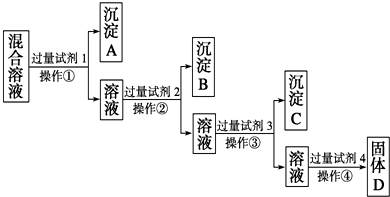
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省成都市玉林中学高一(下)期末化学试卷(解析版) 题型:解答题
 、NO
、NO 的相互分离.相应的实验过程可用如图表示:
的相互分离.相应的实验过程可用如图表示:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com