
 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.- 4 |
- 4 |
2- 4 |
2- 8 |
2- 8 |
+ 4 |
+ 4 |
| 2×cV×10-3mol×14g/mol |
| 0.01L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
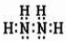
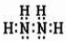
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省扬州市高三第一学期检测试卷化学试卷(解析版) 题型:简答题
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等。
(1)已知:N2(g)+2H2(g)=N2H4(l) △H= + 50.6kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l) △H= kJ·mol-1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 。
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 。
(2)采矿废液中的CN- 可用H2O2处理。已知:H2SO4=H++ HSO4-
HSO4-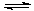 H++ SO42-
H++ SO42-
用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-,S2O82-水解可以得到H2O2。写出阳极上的电极反应式 。
(3)氧化镁处理含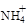 的废水会发生如下反应:
的废水会发生如下反应:
MgO+H2O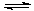 Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+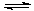 Mg2+ +2NH3·H2O。
Mg2+ +2NH3·H2O。
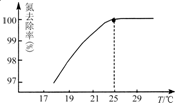
①温度对氮处理率的影响如图所示。在25℃前,升高温度氮去除率增大的原因是 。

②剩余的氧化镁,不会对废水形成二次污染,理由是 。
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下:①取10 mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175 mL②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热③用25 mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3=(NH4)2B4O7+5H2O]④将吸收液移至锥形瓶中,加入2滴指示剂,用c mol·L-1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3],记录消耗的体积V mL。则水样中氮的含量是 mg·L-1(用含c、V的表达式表示)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省高考重点命题预测系列化学试卷(解析版) 题型:填空题
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等。
(1)已知:N2(g)+2H2(g)=N2H4(l) △H= + 50.6kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l) △H= kJ·mol-1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 。
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 。
(2)采矿废液中的CN- 可用H2O2处理。已知:H2SO4=H++ HSO4- HSO4- H++ SO42-
H++ SO42-
用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-,S2O82-水解可以得到H2O2。写出阳极上的电极反应式 。
(3)氧化镁处理含NH4+的废水会发生如下反应:
MgO+H2O Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+ Mg2+ +2NH3·H2O。
Mg2+ +2NH3·H2O。
①温度对氮处理率的影响如图所示。在25℃前,升高温度氮去除率增大的原因是 。

②剩余的氧化镁,不会对废水形成二次污染,理由是 。
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下:①取10 mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175 mL②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热③用25 mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3=(NH4)2B4O7+5H2O]④将吸收液移至锥形瓶中,加入2滴指示剂,用c mol·L-1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3],记录消耗的体积V mL。则水样中氮的含量是 mg·L-1(用含c、V的表达式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com