
【题目】A、B、C、D四种短周期元素的原子序数依次增大,B的核电荷数是A、D核电荷数之和的 ![]() ;A能分别与B、C、D形成电子总数相等的分子X、Y、Z.回答下列问题:
;A能分别与B、C、D形成电子总数相等的分子X、Y、Z.回答下列问题:
(1)B、D两元素的名称分别是、 .
(2)化合物B2A2的电子式为 .
(3)Y与C的最高价氧化物的水化物刚好完全反应时,其生成物的水溶液呈性(填“酸”、“碱”或“中”),原因是:(用离子方程式表示).
(4)在(3)所得生成物的水溶液中,存在如下关系,用离子浓度符号填写: ①c(H+)+=c(OH﹣)+;
②c(H+)=c(OH一)+ .
(5)用X、D2、NaOH溶液和惰性电极可设计一种燃料电池,该燃料电池的 负极反应为: .
正极反应为:
【答案】
(1)碳;氧
(2)![]()
(3)酸;NH4++H2O?NH3?H2O+H+
(4)c(NH4+);c(NO3﹣);c(NH3?H2O)
(5)CH4﹣8e﹣+10OH﹣═CO32﹣+7H2O;2O2+8e﹣+4H2O═8OH﹣
【解析】解:A、B、C、D四种短周期元素的原子序数依次增大,B的核电荷数是A、D核电荷数之和的 ![]() 倍,结合原子序数可知,B处于第二周期,且处于偶数族,A能分别与B、C、D形成电子总数相等的分子X、Y、Z,考虑为氢化物,X为H元素,可推知B为C元素、C为N元素,D为O元素,X、Y、Z分别为CH4、NH3、H2O,验证符合题意,则:(1)由上述分析可知,B为碳,D为氧,所以答案是:碳;氧;(2)化合物B2A2为C2H2 , C原子之间形成三对共用电子对,C原子与H原子之间形成1对共用电子对,其电子式为:
倍,结合原子序数可知,B处于第二周期,且处于偶数族,A能分别与B、C、D形成电子总数相等的分子X、Y、Z,考虑为氢化物,X为H元素,可推知B为C元素、C为N元素,D为O元素,X、Y、Z分别为CH4、NH3、H2O,验证符合题意,则:(1)由上述分析可知,B为碳,D为氧,所以答案是:碳;氧;(2)化合物B2A2为C2H2 , C原子之间形成三对共用电子对,C原子与H原子之间形成1对共用电子对,其电子式为: ![]() , 所以答案是:
, 所以答案是: ![]() ;(3)Y与C的最高正价氧化物的水化物刚好完全反应时,所得溶液为硝酸铵溶液,溶液中NH4+水解NH4++H2ONH3H2O+H+ , 破坏水的电离平衡溶液呈酸性,所以答案是:酸;NH4++H2ONH3H2O+H+;(4)①根据溶液中电荷守恒解,可知c(H+)+c(NH4+)=c(OH﹣)+c(NO3﹣),
;(3)Y与C的最高正价氧化物的水化物刚好完全反应时,所得溶液为硝酸铵溶液,溶液中NH4+水解NH4++H2ONH3H2O+H+ , 破坏水的电离平衡溶液呈酸性,所以答案是:酸;NH4++H2ONH3H2O+H+;(4)①根据溶液中电荷守恒解,可知c(H+)+c(NH4+)=c(OH﹣)+c(NO3﹣),
所以答案是:c(NH4+);c(NO3﹣);②溶液中氢离子来源于水的电离、NH4+水解,根据质子恒等式,可知c(H+)=c(OH﹣)+c(NH3H2O),
所以答案是:c(NH3H2O);(5)负极发生氧化反应,CH4在负极失去电子,碱性条件下生成碳酸根、H2O,负极电极反应式为:CH4﹣8e﹣+10OH﹣═CO32﹣+7H2O,
正极发生还原反应氧气在正极获得电子,碱性条件下生成氢氧根离子,正极电极反应式为;2O2+8e﹣+4H2O═8OH﹣ ,
所以答案是:CH4﹣8e﹣+10OH﹣═CO32﹣+7H2O;2O2+8e﹣+4H2O═8OH﹣ .


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】钠是活泼金属的代表,钠和钠的化合物是中学化学的基础知识.请回答下列问题.
(1)钠跟水剧烈反应,生成和氢气(H2),此实验说明钠的化学性质活泼;
(2)钠有两种氧化物,其中能用于呼吸面具和潜水艇中作为氧气来源的氧化物是;
(3)固体碳酸钠中含有碳酸氢钠杂质,除去该杂质的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物.实验室由芳香烃A制备G的合成路线如下: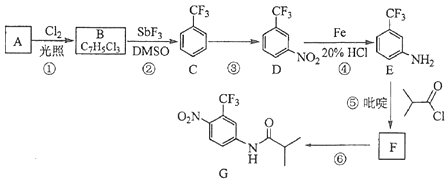
回答下列问题:
(1)A的结构简式为 . C的化学名称是 .
(2)③的反应试剂和反应条件分别是 , 该反应的类型是 .
(3)⑤的反应方程式为 . 吡啶是一种有机碱,其作用是 .
(4)G的分子式为 .
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有种.
(6)4﹣甲氧基乙酰苯胺( ![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚( ![]() )制备4﹣甲氧基乙酰苯胺的合成路线(其他试剂任选).
)制备4﹣甲氧基乙酰苯胺的合成路线(其他试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3 , 不考虑其他杂质)制取七水合硫酸亚铁(FeSO47H2O),设计了如图流程: 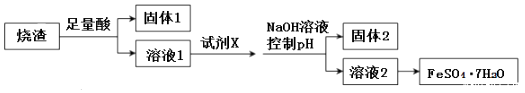
(1)溶解烧渣选用足量酸的化学式为 , 试剂X选用
(2)固体1成分的化学式是 , 固体2成分的化学式
(3)写出固体2与氢氧化钠溶液反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学已经渗透到人类生活的各个方面,下列说法正确的是
A.垃圾焚烧不仅可以用于发电,还不会带来任何新污染
B.喂养鸡的过程中大量使用抗生素,大量进食这样的鸡肉对人体健康有益
C.油脂在人体内水解为氨基酸和甘油等小分子被吸收
D.铜具有良好的导电性,常用来制作印刷电路板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)水中溶解氧是水生生物生存不可缺少的条件.某课外小组采用碘量法测定学校周边河水中的溶解氧.实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样.记录大气压及水体温度.将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2 , 实现氧的固定.
Ⅱ.酸化,滴定
将固氧后的水样酸化,MnO(OH)2被I﹣还原为Mn2+ , 在暗处静置5min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O32﹣+I2=2I﹣+S4O62﹣).
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是 .
(2)“氧的固定”中发生反应的化学方程式为 .
(3)Na2S2O3溶液不稳定,使用前需标定.配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除及二氧化碳.
(4)取100.00mL水样经固氧、酸化后,用a molL﹣1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为mgL﹣1 .
(5)上述滴定完成后,若滴定管尖嘴处留有气泡会导致测量结果偏 . (填“高”或“低”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,在化学反应中常作还原剂的一组是( )
A. HNO3、Cl2、FeCl3、KMnO4
B. Al、CO、O2、H2
C. Zn、C、H2、CO
D. KClO3、MnO2、C、Fe
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com