
【题目】氟他胺G是一种可用于治疗肿瘤的药物.实验室由芳香烃A制备G的合成路线如下: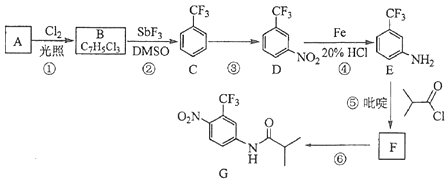
回答下列问题:
(1)A的结构简式为 . C的化学名称是 .
(2)③的反应试剂和反应条件分别是 , 该反应的类型是 .
(3)⑤的反应方程式为 . 吡啶是一种有机碱,其作用是 .
(4)G的分子式为 .
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有种.
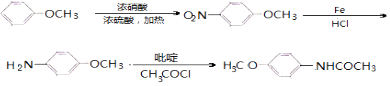
(6)4﹣甲氧基乙酰苯胺( ![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚( ![]() )制备4﹣甲氧基乙酰苯胺的合成路线(其他试剂任选).
)制备4﹣甲氧基乙酰苯胺的合成路线(其他试剂任选).
【答案】
(1)![]() ;三氟甲苯
;三氟甲苯
(2)浓硫酸、浓硝酸,并加热;取代反应
(3)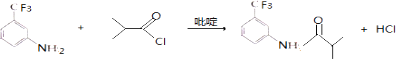 ;吸收反应产物的HCl,提高反应转化率
;吸收反应产物的HCl,提高反应转化率
(4)C11H11O3N2F3
(5)9
(6)
【解析】解:(1)由以上分析可知A为甲苯,结构简式为 ![]() ,C的化学名称是三氟甲苯,所以答案是:
,C的化学名称是三氟甲苯,所以答案是: ![]() ;三氟甲苯;(2)③为三氟甲苯的硝化反应,反应条件是在浓硫酸作用下,加热,与浓硝酸发生取代反应,
;三氟甲苯;(2)③为三氟甲苯的硝化反应,反应条件是在浓硫酸作用下,加热,与浓硝酸发生取代反应,
所以答案是:浓硫酸、浓硝酸,并加热;取代反应;(3)⑤的反应方程式为 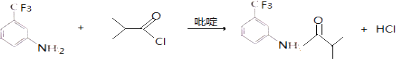 ,反应中吡啶的作用是吸收反应产物的HCl,提高反应转化率,
,反应中吡啶的作用是吸收反应产物的HCl,提高反应转化率,
所以答案是:  ;吸收反应产物的HCl,提高反应转化率;(4)由结构简式可知G的分子式为C11H11O3N2F3 , 所以答案是:C11H11O3N2F3;(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则苯环有3个不同 的取代基,如固定一种取代基,则对应的同分异构体的种类为
;吸收反应产物的HCl,提高反应转化率;(4)由结构简式可知G的分子式为C11H11O3N2F3 , 所以答案是:C11H11O3N2F3;(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则苯环有3个不同 的取代基,如固定一种取代基,则对应的同分异构体的种类为 ![]() =10,或者说,固定﹣CF3和﹣NO2 , 如﹣CF3和﹣NO2处于邻位,另一种取代基有4种位置,﹣CF3和﹣NO2处于间位,另一种取代基有4种位置,﹣CF3和﹣NO2处于对位,另一种取代基有2种位置,共10种,则H可能的结构还有9种,
=10,或者说,固定﹣CF3和﹣NO2 , 如﹣CF3和﹣NO2处于邻位,另一种取代基有4种位置,﹣CF3和﹣NO2处于间位,另一种取代基有4种位置,﹣CF3和﹣NO2处于对位,另一种取代基有2种位置,共10种,则H可能的结构还有9种,
所以答案是:9;(6)由苯甲醚( ![]() )制备4﹣甲氧基乙酰苯胺,可先与浓硝酸发生取代反应生成
)制备4﹣甲氧基乙酰苯胺,可先与浓硝酸发生取代反应生成 ![]() ,发生还原反应生成
,发生还原反应生成 ![]() ,最后与CH3COCl发生取代反应可生成
,最后与CH3COCl发生取代反应可生成 ![]() ,则合成流程为
,则合成流程为 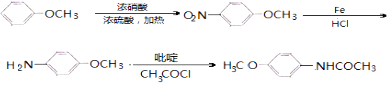 ,
,
所以答案是:  .
.
【考点精析】根据题目的已知条件,利用有机物的结构和性质的相关知识可以得到问题的答案,需要掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解.


科目:高中化学 来源: 题型:
【题目】下列有关物质的量的说法中,正确的是( )
A.Fe的摩尔质量为56g
B.常温常压下,71gCl2含有NA个Cl2分子
C.1mol O2在常温下的体积都为22.4L
D.将1molNaCl晶体加入到1L水中,得到NaCl溶液的浓度就是1molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于水玻璃的叙述不正确的是 ( )
A.它是一种矿物胶,既不能燃烧也不易腐蚀
B.在建筑工业上可用黏合剂和耐火材料
C.它在空气中易变质,因为Na2O·nSiO2+CO2+mH2O===Na2CO3+nSiO2·mH2O
D.水玻璃的主要成分是二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其合金的说法不正确的是
A. 目前我国流通的硬币是由合金材料制成的
B. 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
C. 出土的古代铜制品表面覆盖着铜绿,其主要成分是CuO
D. 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.23 g Na与足量H2O反应完全后可生成NA个H2分子
B.1 mol Cu和足量热浓硫酸反应可生成NA个SO3分子
C.标准状况下,22.4 L Cl2含NA个原子
D.3 mol单质Fe完全转变为Fe3O4 , 失去8 NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据实验内容填空:
(1)工业上用铁质容器盛装冷的浓硫酸(填“能”或“不能”).为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(2)[探究一] 将已去除表面氧化物的铁钉(碳素钢)放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+ . 若要确认其中的Fe2+ , 应选用
a.KSCN溶液 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4 , 用单线桥表示电子转移情况 ,
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由此推知气体Y中SO2的体积分数为 .
(3)[探究二] 分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体.为此设计了下列探究实验装置(图中夹持仪器省略).
装置B中试剂的作用是 .
(4)认为气体Y中还含有CO2的理由是(用化学方程式表示).
(5)为确认CO2的存在,需在装置中添加M于,M中盛装的是(选填序号). a.A之前,NaOH溶液 b.A﹣B间,NaOH溶液
c.B﹣C间,澄清石灰水 d.C﹣D间,澄清石灰水
(6)如果气体Y中含有H2 , 预计实验现象应是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素的原子序数依次增大,B的核电荷数是A、D核电荷数之和的 ![]() ;A能分别与B、C、D形成电子总数相等的分子X、Y、Z.回答下列问题:
;A能分别与B、C、D形成电子总数相等的分子X、Y、Z.回答下列问题:
(1)B、D两元素的名称分别是、 .
(2)化合物B2A2的电子式为 .
(3)Y与C的最高价氧化物的水化物刚好完全反应时,其生成物的水溶液呈性(填“酸”、“碱”或“中”),原因是:(用离子方程式表示).
(4)在(3)所得生成物的水溶液中,存在如下关系,用离子浓度符号填写: ①c(H+)+=c(OH﹣)+;
②c(H+)=c(OH一)+ .
(5)用X、D2、NaOH溶液和惰性电极可设计一种燃料电池,该燃料电池的 负极反应为: .
正极反应为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表).回答下列问题:
(1)氮原子价层电子对的轨道表达式(电子排布图)为 .
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1).第二周期部分元素的E1变化趋势如图(a)所示, 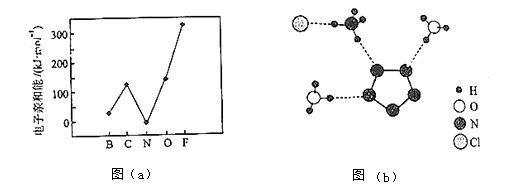
其中除氮元素外,其他元素的E1自左而右依次增大的原因是;氮元素的E1呈现异常的原因是 .
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示.
①从结构角度分析,R中两种阳离子的相同之处为 , 不同之处为 . (填标号)
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型
②R中阴离子N5﹣中的σ键总数为个.分子中的大π键可用符号Πmn表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π66),则N5﹣中的大π键应表示为 .
③图(b)中虚线代表氢键,其表示式为(NH4+)N﹣H…Cl、、 .
(4)R的晶体密度为dgcm﹣3 , 其立方晶胞参数为anm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向硫酸酸化的淀粉碘化钾溶液中滴入少量次氯酸钠溶液,溶液立即变蓝;再向上述溶液中滴加过量亚硫酸钠溶液,蓝色恰好完全褪去.
(1)碘化钾与次氯酸钠反应的离子方程式;+CIO﹣+I﹣═CI﹣+I2+
(2)用双线桥法表示电子得失的方向和数目:Na2SO3+I2+H2O═Na2SO4+2HI
(3)以上实验条件下,SO42﹣、I2和CIO﹣的氧化性有强到弱的顺序是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com