
【题目】NA为阿伏加德罗常数的值,下列物质所含粒子数为0.2NA的是( )
①标准状况下,2.24L Cl2中含有的共价键数
②常温下,2L pH=13的Na2CO3溶液中含有的OH﹣离子数
③100mL 1.0mo1L﹣1的NaAlO2溶液中含有的氧原子数
④标准状况下,2.24L Cl2与足量的NaOH溶液反应时转移的电子数
⑤3.2gO2和O3的混合气体中含有的氧原子数
⑥3.9g Na2O2晶体中所含的离子总数.
A.②③⑥
B.②⑤
C.③⑤⑥
D.④⑥
【答案】B
【解析】解:①标准状况下,2.24L Cl2的物质的量为0.1mol,而1mol氯气中含1mol共价键,故0.1mol氯气中含0.1mol共价键即0.1NA个,故①错误;
②常温下,pH=13的Na2CO3溶液中含有的OH﹣的浓度为0.1mol/L,故氢氧根的物质的量n=CV=0.1mol/L×2L=0.2mol,即0.2NA个,故②正确;
③100mL 1.0mo1L﹣1的NaAlO2溶液中除了偏铝酸钠,水也含氧原子,故溶液中的氧原子的个数大于0.2NA个,故③错误;
④标准状况下,2.24L Cl2的物质的量为0.1mol,而氯气和氢氧化钠的反应为歧化反应,1mol氯气转移1mol电子,则0.1mol氯气转移0.1mol电子即0.1NA个,故④错误;
⑤O2和O3均由氧原子构成,故3.2g混合物中含有的氧原子的物质的量为n= ![]() =0.2mol,个数为0.2NA个,故⑤正确;
=0.2mol,个数为0.2NA个,故⑤正确;
⑥3.9g Na2O2的物质的量为0.05mol,而1mol过氧化钠中含2mol钠离子和1mol阴离子,故0.05mol过氧化钠中含0.15mol离子即0.15NA个,故⑥错误.
故选B.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】某同学设计如图1所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
实验 | 药品 | 制取气体 | 量气管中的液体 |
Ⅰ | Cu、稀HNO3 | H2O | |
Ⅱ | NaOH固体、浓氨水 | NH3 | |
Ⅲ | Na2SO3固体、浓H2SO4 | SO2 | |
Ⅳ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
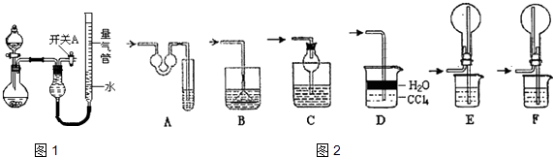
(1)实验过程中,使用分液漏斗滴加液体的操作是 .
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?(填“可行”或“不可行”).原因为
(3)实验Ⅲ烧瓶中产生的SO2气体通入溴水溶液中发生反应的离子方程式是 .
(4)实验Ⅱ中量气管中的液体最好是(填字母编号,下同).
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
该实验剩余的NH3需吸收处理.如图2,以下各种尾气吸收装置中,适合于吸收NH3 , 而且能防止倒吸的有 .
(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,② , ③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积已换算成标准状况,忽略滴入液体体积对气体体积的影响)
编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
① | 1.0g | 10.0mL | 346.3mL |
② | 1.0g | 10.0mL | 335.0mL |
③ | 1.0g | 10.0mL | 345.7mL |
根据上述数据,可计算出镁铝合金中铝的质量分数为 . (H:1 Mg:24 Al:27)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比较下列各组热化学方程式中ΔH的大小关系。
(1)S(s)+O2(g)===SO2(g) ΔH1
S(g)+O2(g)===SO2(g) ΔH2
ΔH1__________ΔH2
(2)CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2
ΔH1__________ΔH2
(3)4Al(s)+3O2(g)===2Al2O3(s) ΔH1
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH2
ΔH1__________ΔH2
(4)煤作为燃料有2种途径:
途径1——直接燃烧:
C(s)+O2(g)===CO2(g) ΔH1<0
途径2——先制水煤气:
C(s)+H2O(g)===CO(g)+H2(g) ΔH2>0
再燃烧水煤气:
2CO(g)+O2(g)===2CO2(g) ΔH3<0
2H2(g)+O2(g)===2H2O(g) ΔH4<0
ΔH1、ΔH2、ΔH3、ΔH4的关系式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业中电解饱和食盐水的原理示意图如图所示: 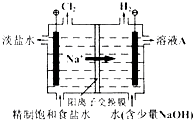
(1)溶液A的溶质是;
(2)电解饱和食盐水的离子方程式是;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用平衡移动移动原理解释盐酸的作用:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100g碳燃烧所得气体中,CO占![]() ,CO2占
,CO2占![]() 体积,且C(s)+
体积,且C(s)+![]() O2(g)===CO(g);ΔH(298K)=-110.35kJ·mol-1,CO(g)+
O2(g)===CO(g);ΔH(298K)=-110.35kJ·mol-1,CO(g)+![]() O2(g)===CO2(g);ΔH(298K)=-282.57kJ·mol-1。与这些碳完全燃烧相比较,损失的热量是( )
O2(g)===CO2(g);ΔH(298K)=-282.57kJ·mol-1。与这些碳完全燃烧相比较,损失的热量是( )
A.392.92kJ B.2489.44kJ
C.784.92kJ D.3274.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2X(g)+Y(g)a Z(g),在T1温度下,体积为2L的密闭容器中,充入6mol X和2mol Y.根据图示回答: 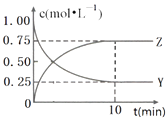
(1)a=;用Y的浓度变化表示从反应开始到平衡时的平均反应速率为mol/(Lmin).
(2)平衡时,Y在混合物中的物质的量分数是
(3)其他条件不变时,下列措施可以提高Y的转化率的是(选填字母).
A.使用适当的催化剂
B.分离出Z
C.增大容器体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温时,在密闭容器中进行可逆反应:N2+3H22NH3 , 达到平衡后,欲使正反应速率增大,可采取的措施是( )
A.缩小容器的容积
B.保持容器的容积不变,通入稀有气体
C.保持容器内压强不变,通入稀有气体
D.及时把生成的NH3分离出去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com