
| A、钢铁在潮湿空气中生锈属于电化学腐蚀 |
| B、电化学腐蚀一般可分为吸氧腐蚀和析氢腐蚀 |
| C、金属腐蚀的本质是金属原子失去电子被氧化的过程 |
| D、铝具有很强的抗腐蚀能力,是因为其不易与氧气发生反应 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
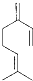 ,(已知CH2=CH-CH=CH2 与等物质的量H2反应还可生成 CH3-CH=CH-CH3(且只考虑位置异构)一分子该物质与两分子溴发生加成反应的产物理论上最多有( )
,(已知CH2=CH-CH=CH2 与等物质的量H2反应还可生成 CH3-CH=CH-CH3(且只考虑位置异构)一分子该物质与两分子溴发生加成反应的产物理论上最多有( )| A、2种 | B、3种 | C、4种 | D、6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用碳酸钠与醋酸制取少量二氧化碳 |
| B、泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将其混合就可产生大量二氧化碳的泡沫 |
| C、厨房中常用碳酸钠溶液洗涤餐具上的油污 |
| D、实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B、逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C、正反应速率先减小后增大,逆反应速率减小,平衡向逆反应方向移动 |
| D、逆反应速率先减小后增大,正反应速率减小,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物 质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
| A、该反应是吸热反应 |
| B、该反应的平衡常数随温度的升高而增大 |
| C、压强升高时平衡常数也随之增大 |
| D、该反应的平衡常数随温度的升高而减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
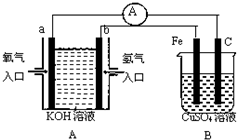 根据如图所示装置回答问题:
根据如图所示装置回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性:Sn4+<Sn2+ |
| B、氧化性:Fe3+<Sn4+ |
| C、还原性:Fe2+<Sn2+ |
| D、还原性:Fe<Sn |
查看答案和解析>>
科目:高中化学 来源: 题型:
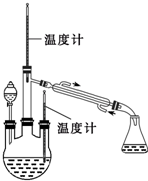 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4?H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4?H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4?H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4?H2O+NaCl查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com