
【题目】根据下图判断,下列说法正确的是( )

A. 装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-Fe2+
B. 装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-4OH-
C. 装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动
D. 放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】内锌矿的主要成分为ZnS,含有杂质PbS、CuS、FeS、SiO2等,以闪锌矿制备氯化锌的流程如图所示。

请回答下列问题:
(1)配制氯化铁浸渍液时要求pH为0.8~1之间,pH太高则 ,pH太低,浸渍矿石会产生有害气体 ,操作①是 。由氯化锌溶液制备氯化锌晶体的方法是 。
(2)高沸点溶剂R—4E几乎不溶于水,120℃时硫在R—4E里的溶解度为365g,室温时溶解度为35.9g,从浸出液B提取硫的方法是 。硫是工业制备硫酸的原料,现有1吨矿石,硫的总含量为24%,最多制备浓度98%的硫酸 吨。
(3)氯化铁与硫化锌发生反应:![]() ,则氯化铁与FeS反应的方程式为 。
,则氯化铁与FeS反应的方程式为 。
(4)溶液X的成分的化学式为 ,该流程中循环使用的物质是 。
(5)由氯化亚铁溶液制备氯化铁溶液,可以用![]() 、
、![]() ,但生产成本高。酸性条件下,使用催化剂在50℃左右通入氧气转化的成本极低,反应的离子方程式为 。
,但生产成本高。酸性条件下,使用催化剂在50℃左右通入氧气转化的成本极低,反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
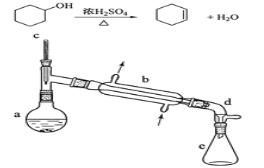
可能用到的有关数据如下:
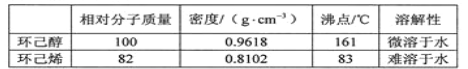
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是 。
(2)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作时 (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为 。
(4)分液漏斗在使用前须清洗干净并 ;在本实验分离过程中,产物应该从分液漏斗的 (填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是 。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有 (填正确答案标号)。
A.蒸馏烧瓶
B.温度计
C.吸滤瓶
D.球形冷凝管
E.接收器
(7)本实验所得到的环己烯产率是 (填正确答案标号)。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ/mol
2C(s)+O2(g)=2CO(g) ΔH=-220kJ/mol,H-H、O=O和O-H键的键能分别为436、496和462kJmol-1,则a为( )
A.-332 B.-118 C.+350 D.+130
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中仪器使用不正确的是( )
A. 容量瓶未经干燥不能用来配制溶液 B. 用铁坩埚灼烧烧碱
C. 中和热的测定实验中用环形玻璃棒搅拌 D. 加热蒸发皿时不用石棉网
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示。下列结论错误的是

A.反应开始2 min内平均反应速率最大
B.反应4~6 min内平均反应速率最小
C.反应开始4 min内温度对反应速率的影响比浓度大
D.反应在第2 min到第4 min间生成CO2 的平均反应速率最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
A. 开始加入合金的质量可能为3.6g
B. 参加反应的硝酸的物质的量为0.1mol
C. 沉淀完全时消耗NaOH溶液的体积为100mL
D. 溶解合金时产生NO的体积为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵广泛应用与工农生产中,其生产流程图如下,回答下列问题:
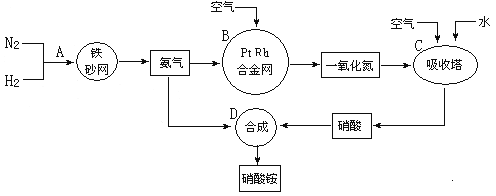
(1)在上述工业制硝酸的生产中,B设备的名称是 ,在反应中的氧化产物是 。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是 。在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(3)科学家以氨(NH3)为燃料开发新型的燃料电池。电池中填充可传导O2—离子的 MnO3固体电解质,电池总反应为:4NH3+3O2=2N2+6H2O。负极的电极反应式为 。
(4)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量约占总耗NH3质量(不考虑其它损耗)的 %。(取两位有效数字)
(5)硝酸铵是一种常用的氮肥,在使用该化肥时避免与碱性肥料一起使用,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝用途广泛,用铝土矿(主要成分为Al2O3·nH2O、少量SiO2和Fe2O3)制取Al有如下途径:

(1)滤液A可用于净水,其净水原理用离子方程式表示为_________________。
(2)灼烧时盛放药品的仪器名称是______________
(3)步骤Ⅴ中发生反应的化学方程式是________________________。
(4)步骤Ⅲ中生成固体C的离子反应方程式为__________________________。
(5)取滤液B 100 mL,加入1 mol/L盐酸200 mL,沉淀量达到最大且质量为11.7 g。则滤液B中c(Al O2-)=_____________。(4分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com