
【题目】工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用该原理处理污水,设计装置如图所示。下列说法正确的是
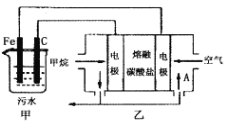
A.为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液
B.甲装置中Fe电极的反应为Fe-3e-=Fe3+
C.当乙装置中有1.6gCH4参加反应,则C电极理论上生成气体体积为4.48L
D.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2
【答案】D
【解析】
甲装置为电解池,乙装置为原电池装置,原电池工作时,通入甲烷的一级为负极,发生氧化反应,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,通入氧气的一级为正极,发生还原反应,正极反应为O2+2CO2+4e-=2CO32-,电解池中Fe为阳极,发生Fe-2e-=Fe2+,阴极的电极反应为:2H++2e-=H2↑,二价铁离子具有还原性,能被氧气氧化到正三价,4Fe2++10H2O+O2=4Fe(OH)3↓+8H+,以此解答该题。
A.保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀时,加入能使导电能力增强的电解质必须是可溶于水的、显中性的盐,加入硫酸不能生成Fe(OH)3沉淀,故A错误;
B.电解池中Fe为阳极,发生Fe-2e-=Fe2+,故B错误;
C.阴极的电极反应为:2H++2e-=H2↑,阴极产生了44.8L(标准状况)即2mol的氢气产生,所以转移电子的物质的量为4mol,根据电池的负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,当乙装置中有1.6 gCH4参加反应,即0.1mol甲烷参加反应时,有0.8mol电子转移,则C电极理论上生成气体在标准状况下为8.96L,故C错误;
D.电池是以熔融碳酸盐为电解质,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,正极反应为O2+2CO2+4e-=2CO32-,可以循环利用的物质只有二氧化碳,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】苯和溴的取代反应的实验装置如图所示。其中A为带支管的试管改成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入铁屑粉少量。

(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式:____________、____________;试管C中苯的作用____________。
(2)反应开始后,D、E试管的现象分别为__________________、____________; E中所发生反应的离子方程式为____________。
(3)在上述整套装置中,具有防倒吸作用的仪器有(填字母) ____________。
(4)上述实验装置除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这3个优点外,还有一个优点____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚砷酸(H3AsO3)可用于白血病的治疗。室温下,配制一组c(H3AsO3)+c(H2AsO3-)+c(HAsO32-)+c(AsO33-)=0.100 mol·L-1的H3AsO3和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化关系曲线如图所示。下列指定溶液中微粒的物质的量浓度关系正确的是( )
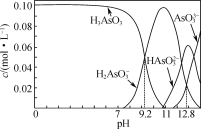
A.pH=11的溶液中:c(HAsO32-)+c(AsO33-)>c(H2AsO3-)
B.c(Na+)=0.100 mol·L-1的溶液中:c(H2AsO3-)>c(H3AsO3)>c(HAsO32-)
C.c(Na+)=0.200 mol·L-1的溶液中:c(H+)+2c(H3AsO3)=c(OH-)+c(AsO33-)
D.pH=12.8的溶液中:c(H+)+c(Na+)>4c(H2AsO3-)+c(HAsO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境、科学、技术密切相关。下列有关说法中正确的是( )
A.华为首款5G手机搭载了智能的7nm制程SoC麒麟980芯片,此芯片主要成分是二氧化硅
B.用于制作N95型口罩的“熔喷布”主要原料是聚丙烯,聚丙烯的分子长链上无支链
C.国产飞机C919用到的氮化硅陶瓷是传统有机非金属材料
D.侯氏制碱法的工艺过程中应用了物质溶解度的差异
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的HR溶液中逐滴加入0.1mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )
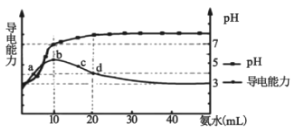
A.溶液中的阳离子浓度总和最大的是d点
B.常温下,HR的电离平衡常数数量级为10-8
C.b点和d点溶液中,水的电离程度不相等
D.d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业含铜废料含有 Cu、CuO、CuS、CuSO4 等成分,利用该含铜废料可生产硝酸铜晶体[Cu(NO3)2·3H2O],生产的工艺流程如图所示,请回答下列问题:

(1)“焙烧”过程中生成的废气中有害气体的成分是______________。
(2)“酸化”过程为加快反应速率,可采用的措施有___________________________(写出一条即可)。
(3)若试剂 a 可以是____________,试剂b的作用是______________________________________。
(4)“反应”一步中使用 20% HNO3 和 10% H2O2,整个过程无红棕色气体产生,则发生反应的离子方程式为______________________________________;若该步骤只使用 20% HNO3,随着反应的进行,温度升高,出现大量红棕色气体,则还原剂与氧化剂的物质的量之比为_______________。
(5)“系列操作”中应包含____________、______________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种新型离子化合物,该物质由两种阳离子和两种阴离子构成,其中有一种 18 电子离子和两种 10 电子离子。W、X、Y、Z 均为短周期元素,且均不在同一主族。下列说法不正确的是
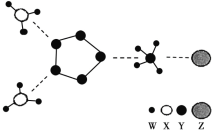
A.X 与 W 形成的化合物沸点高于 X 同族元素与 W 形成的化合物
B.Z 的最高价氧化物对应水化物的酸性比 Y 的强
C.Y 气态氢化物的稳定性比 X 的强
D.如图化合物中,存在极性共价键和非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO42﹣、Cl﹣
B.![]() =1×10﹣15mol/L的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
=1×10﹣15mol/L的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3﹣、SO42﹣
D.水电离的c(H+)=1×10﹣15mol/L的溶液中:K+、Na+、AlO2﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中各盛放有100mL2mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,充分反应结束后测得生成的气体体积比为甲:乙=3:4,则加入铝粉的质量为( )
A.4.8gB.3.2gC.2.4gD.1.6g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com