
【题目】常温下,向10mL0.1mol/L的HR溶液中逐滴加入0.1mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )
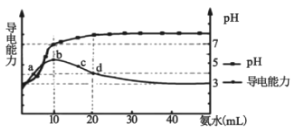
A.溶液中的阳离子浓度总和最大的是d点
B.常温下,HR的电离平衡常数数量级为10-8
C.b点和d点溶液中,水的电离程度不相等
D.d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
【答案】C
【解析】
A.溶液导电能力只与离子浓度有关,根据图象可知,b点导电能力最强,离子浓度最大,则溶液中的阳离子浓度总和最大的是b点,故A错误;
B.根据图象可知,0.1mol/L的HR溶液的pH=3,则c(H+)=10-3mol/L,c(R-)≈c(H+)=10-3mol/L,c(HR)≈0.1mol/L,根据HR ![]() H++R-,HR的电离平衡常数Ka=
H++R-,HR的电离平衡常数Ka= ![]() =
= ![]() =10-5,故B错误;
=10-5,故B错误;
C.酸或碱抑制水电离,盐类的水解促进水电离,在b点时HR与氨水恰好完全反应生成NH4R,溶质为含有弱离子的盐水解,促进水电离;在d点时,氨水过量,是弱碱,抑制水电离,所以b、d两点水电离程度不等,故C正确;
D.d点加入20mL等浓度的氨水,反应后溶质为等浓度的NH4R和NH3·H2O,根据物料守恒可得:2c(R-)+2c(HR)=c(NH3H2O)+c(NH4+),电荷守恒可得:c(NH4+)+c(H+)=c(R-)+c(OH-),两式相加可得:2c(HR)+c(R-)+c(H+)=c(NH3H2O)+c(OH-),故D错误。
答案为C。


科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
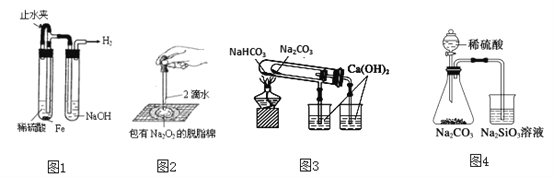
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A. v(A2)=0.8 mol·L-1·s-1 B. v(A2)=30 mol·L-1·min-1
C. v(AB3)=1.0 mol·L-1·s-1 D. v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的有几项( )
①热稳定性:Na2CO3>NaHCO3
②常温时在水中的溶解度:NaHCO3<Na2CO3
③Na2CO3不能转化成NaHCO3,而NaHCO3能转化成Na2CO3
④NaHCO3加热至200℃左右,可完全分解,利用这种性质,可由NaHCO3制取纯碱
⑤当NaHCO3与Na2CO3质量相同时,分别跟足量盐酸反应,NaHCO3可得到较多的二氧化碳
⑥Na2CO3·10H2O在空气中会风化
⑦某物质焰色反应呈黄色,该物质一定是钠盐
A.4B.5C.6D.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁一空气电池是一种能被水激活的一次性储备电池,原理如图所示。下列说法错误的是( )

A.放电时,外电路电子由多孔碳材料电极流向镁电极
B.放电时,正极的电极反应式为O2+4e-+2H2O=4OH-
C.理论上,外电路中流过2mol电子时,负极质量增加34g
D.电池反应产物Mg(OH)2经过灼烧与还原可制成镁从而循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用该原理处理污水,设计装置如图所示。下列说法正确的是
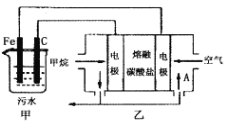
A.为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液
B.甲装置中Fe电极的反应为Fe-3e-=Fe3+
C.当乙装置中有1.6gCH4参加反应,则C电极理论上生成气体体积为4.48L
D.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,可逆反应:A2(g)+B2(g)![]() xC(g)符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是
xC(g)符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是

A.P3<P4,Y轴表示A2的转化率
B.P3>P4,Y轴表示A2的浓度
C.P3>P4,Y轴表示混合气体的密度
D.P3>P4,Y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
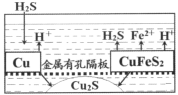
【题目】一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜晶体的工艺流程如图所示:
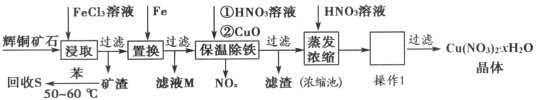
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:________。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S+2CuCl2=4CuCl+S;②__________。
(3)向滤液M中加入(或通入)_______________(填字母),所得物质可循环利用。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(4)“保温除铁”过程中,加入CuO的目的是______________;向浓缩池中加入适量HNO3的作用是_____________。操作1是_______________。
(5)某探究性小组的研究成果如图所示,可以用废铜屑和黄铜矿来富集Cu2S。通入的硫化氢的作用是_____________,当转移0.2mol电子时,生成Cu2S________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.18g氨基(-ND2)中含有的电子数为10NA
B.56gFe与1molCl2充分反应后转移电子的数目为3NA
C.向密闭容器中加入2molNO和1molO2,充分反应后容器中产物分子的数目为2NA
D.向100mL0.1mol/LNH4Cl溶液中通入NH3至溶液为中性,其中NH4+的数目为0.01NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com